Dalam dunia kimia analitik, standarisasi merupakan proses penting untuk memastikan akurasi dan presisi pengukuran. Salah satu proses standarisasi yang umum digunakan adalah standarisasi NaOH dengan asam oksalat. Proses ini sangat penting untuk mengkalibrasi larutan NaOH dan menentukan konsentrasinya yang tepat.
Asam oksalat, senyawa organik yang memiliki sifat unik, memainkan peran penting dalam standarisasi NaOH. Sifatnya yang dapat membentuk kompleks stabil dengan ion logam, seperti ion kalsium, menjadikannya reagen yang ideal untuk proses ini.
Pengertian Standarisasi
Standarisasi dalam kimia adalah proses penentuan konsentrasi atau aktivitas suatu larutan secara akurat.
Proses ini melibatkan penentuan konsentrasi larutan dengan membandingkannya dengan larutan dengan konsentrasi yang diketahui, yang disebut larutan standar.
Proses Standarisasi Umum
- Pilih indikator yang berubah warna pada titik ekivalen.
- Tambahkan larutan standar secara bertahap ke larutan yang tidak diketahui konsentrasinya sambil mengaduk.
- Amati perubahan warna indikator dan hentikan penambahan larutan standar ketika titik ekivalen tercapai.
- Hitung konsentrasi larutan yang tidak diketahui menggunakan persamaan kimia yang sesuai dan volume larutan yang digunakan.
Standarisasi NaOH

Standarisasi NaOH adalah proses menentukan konsentrasi larutan NaOH secara tepat. Standarisasi ini penting untuk memastikan akurasi dalam analisis kimia dan aplikasi lainnya yang melibatkan NaOH.
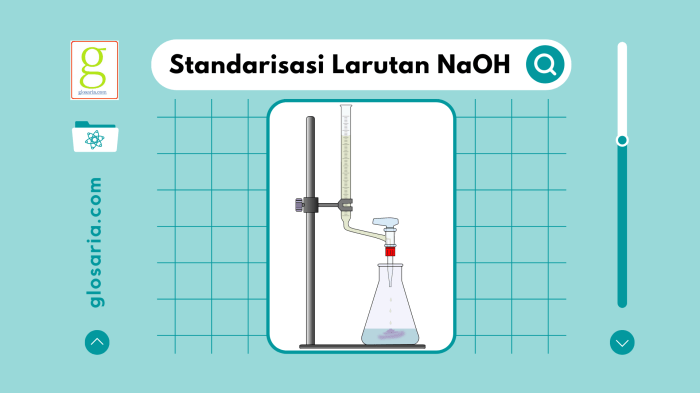
Metode umum yang digunakan untuk standarisasi NaOH adalah titrasi. Titrasi melibatkan penambahan larutan standar yang diketahui konsentrasinya (titer) ke dalam larutan NaOH hingga mencapai titik ekuivalen, yaitu ketika jumlah ekivalen titer sama dengan jumlah ekivalen NaOH.
Langkah-Langkah Standarisasi NaOH Menggunakan Asam Oksalat
- Timbang sekitar 0,1-0,2 gram asam oksalat terhidrasi (H2C2O4·2H2O) secara akurat dan larutkan dalam air suling untuk menghasilkan larutan sekitar 100 mL.
- Tambahkan 2-3 tetes indikator fenolftalein ke dalam larutan asam oksalat.
- Isi buret dengan larutan NaOH yang akan distandarisasi.
- Titrasi larutan asam oksalat dengan larutan NaOH dari buret secara perlahan, aduk terus-menerus.
- Titik ekuivalen tercapai ketika larutan berubah warna menjadi merah muda pucat dan warna ini bertahan selama 30 detik.
- Catat volume larutan NaOH yang digunakan untuk mencapai titik ekuivalen.
Asam Oksalat
Asam oksalat adalah senyawa organik yang memiliki rumus kimia H 2 C 2 O 4 . Senyawa ini merupakan asam dikarboksilat yang terdiri dari dua gugus karboksil (-COOH) yang terikat pada atom karbon pusat.
Asam oksalat banyak ditemukan di alam, terutama pada tumbuhan seperti bayam, rhubarb, dan coklat.
Asam oksalat memiliki sifat asam yang kuat dan dapat melarut dalam air. Dalam larutan, asam oksalat terdisosiasi menjadi ion hidrogen (H + ) dan ion oksalat (C 2 O 4 2- ). Senyawa ini memiliki sifat reduktor dan dapat bereaksi dengan oksidator kuat, seperti kalium permanganat (KMnO 4 ) dan kalium dikromat (K 2 Cr 2 O 7 ).
Peran Asam Oksalat dalam Standarisasi NaOH
Asam oksalat berperan penting dalam standarisasi natrium hidroksida (NaOH). NaOH adalah basa kuat yang banyak digunakan dalam berbagai aplikasi industri dan laboratorium. Standarisasi NaOH dilakukan untuk menentukan konsentrasi NaOH dalam suatu larutan dengan akurat.
Dalam proses standarisasi, asam oksalat digunakan sebagai standar primer. Standar primer adalah senyawa yang memiliki kemurnian tinggi dan dapat bereaksi secara stoikiometri dengan analit yang akan diukur. Asam oksalat bereaksi dengan NaOH dalam reaksi berikut:
“`H 2 C 2 O 4 + 2NaOH → Na 2 C 2 O 4 + 2H 2 O“`Reaksi ini berlangsung secara stoikiometri, sehingga jumlah NaOH yang bereaksi dapat dihitung dari jumlah asam oksalat yang digunakan.
Dengan mengetahui jumlah NaOH yang bereaksi, konsentrasi NaOH dalam larutan dapat ditentukan.
Perbandingan Sifat Fisik dan Kimia NaOH dan Asam Oksalat
Berikut adalah tabel yang membandingkan sifat fisik dan kimia NaOH dan asam oksalat:
| Sifat | NaOH | Asam Oksalat |
|---|---|---|
| Rumus kimia | NaOH | H2C2O4 |
| Massa molar (g/mol) | 40,00 | 90,03 |
| Titik leleh (°C) | 318,4 | 189,5 |
| Titik didih (°C) | 1390 | 157 |
| Kelarutan dalam air (g/100 mL) | 109 | 3,7 |
| Sifat asam/basa | Basa kuat | Asam kuat |
Perhitungan Standarisasi
Standarisasi NaOH melibatkan perhitungan konsentrasi NaOH yang tepat menggunakan asam oksalat. Proses ini mencakup beberapa langkah:
Susun Rumus Perhitungan Konsentrasi NaOH
Rumus untuk menghitung konsentrasi NaOH yang distandarisasi adalah:
C NaOH = (C H2C2O4 x V H2C2O4 ) / V NaOH
Dimana:
- CNaOH = Konsentrasi NaOH yang distandarisasi (mol/L)
- CH2C2O4 = Konsentrasi asam oksalat (mol/L)
- VH2C2O4 = Volume asam oksalat yang digunakan (L)
- VNaOH = Volume NaOH yang digunakan (L)
Contoh Perhitungan Standarisasi NaOH
Sebagai contoh, jika 25,00 mL asam oksalat 0,1000 mol/L dititrasi dengan NaOH dan membutuhkan 20,00 mL NaOH untuk mencapai titik ekivalen, maka konsentrasi NaOH yang distandarisasi adalah:
C NaOH = (0,1000 mol/L x 25,00 mL) / 20,00 mL = 0,1250 mol/L
Sumber Kesalahan Umum dalam Standarisasi NaOH
Beberapa sumber kesalahan umum dalam standarisasi NaOH meliputi:
- Kesalahan pipet dalam mengukur volume asam oksalat dan NaOH
- Ketidaktepatan titik akhir titrasi
- Ketidakmurnian reagen
- Variasi suhu
Aplikasi Standarisasi NaOH

NaOH yang distandarisasi memiliki beragam aplikasi dalam analisis kimia, khususnya dalam titrasi. NaOH yang distandarisasi digunakan untuk menentukan konsentrasi asam yang tidak diketahui dengan tepat.
Titrasi Asam-Basa
NaOH yang distandarisasi digunakan dalam titrasi asam-basa untuk menentukan konsentrasi asam yang tidak diketahui. Titrasi melibatkan penambahan bertahap NaOH ke dalam larutan asam hingga titik ekivalen tercapai. Titik ekivalen adalah titik di mana jumlah mol basa sama dengan jumlah mol asam, yang dapat dideteksi menggunakan indikator atau konduktometer.
Contoh Penggunaan
- Menentukan konsentrasi asam asetat dalam cuka.
- Menentukan konsentrasi asam klorida dalam larutan pembersih.
- Menentukan konsentrasi asam sulfat dalam baterai timbal-asam.
Eksperimen Penentuan Konsentrasi Asam Tidak Diketahui
Tujuan: Menentukan konsentrasi asam tidak diketahui menggunakan NaOH yang distandarisasi.
Bahan:
- NaOH yang distandarisasi
- Asam tidak diketahui
- Indikator fenolftalein
- Buret
- Erlenmeyer
Prosedur:
- Pipet 10 mL asam tidak diketahui ke dalam Erlenmeyer.
- Tambahkan 2-3 tetes indikator fenolftalein.
- Isi buret dengan NaOH yang distandarisasi.
- Tambahkan NaOH secara bertahap ke dalam larutan asam sambil diaduk terus-menerus.
- Hentikan penambahan ketika larutan berubah menjadi merah muda pucat permanen.
- Catat volume NaOH yang digunakan.
Perhitungan:
Konsentrasi asam tidak diketahui dapat dihitung menggunakan rumus:
Konsentrasi Asam = (Konsentrasi NaOH x Volume NaOH) / Volume Asam
Dengan mengetahui konsentrasi NaOH dan volume NaOH yang digunakan, konsentrasi asam tidak diketahui dapat ditentukan.
Simpulan Akhir
Standarisasi NaOH dengan asam oksalat adalah metode yang andal dan banyak digunakan untuk menentukan konsentrasi NaOH yang akurat. Metode ini memiliki aplikasi luas dalam berbagai bidang kimia, termasuk analisis lingkungan, farmasi, dan industri makanan. Dengan memahami prinsip dan prosedur standarisasi, para analis dapat memastikan akurasi dan keandalan hasil pengukuran mereka.
Tanya Jawab (Q&A)
Apa tujuan standarisasi NaOH?
Tujuan standarisasi NaOH adalah untuk menentukan konsentrasi sebenarnya dari larutan NaOH, memastikan akurasi pengukuran dalam titrasi dan analisis lainnya.
Mengapa asam oksalat digunakan dalam standarisasi NaOH?
Asam oksalat digunakan karena membentuk kompleks stabil dengan ion kalsium, yang memungkinkan penentuan konsentrasi NaOH secara akurat melalui titrasi.
Apa sumber kesalahan umum dalam standarisasi NaOH?
Sumber kesalahan umum meliputi ketidaktepatan pengukuran volume, ketidakmurnian reagen, dan kesalahan penimbangan.
