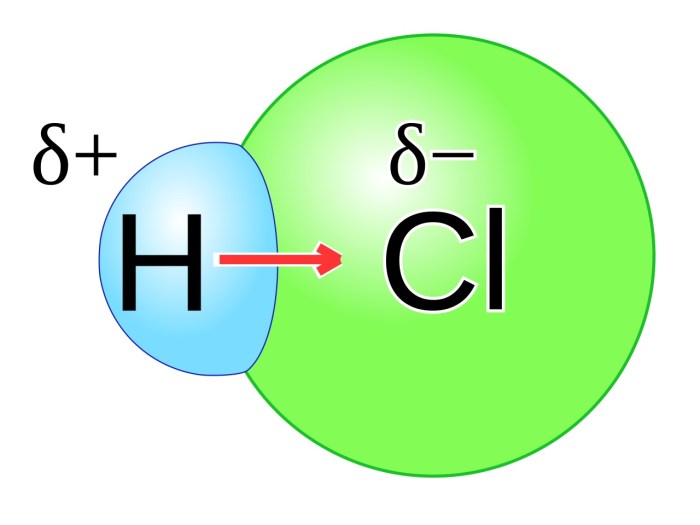
Dalam dunia kimia, ikatan antar atom memegang peranan penting dalam menentukan sifat materi. Ikatan kimia dapat diklasifikasikan menjadi dua kategori utama: ikatan polar dan nonpolar. Perbedaan fundamental antara kedua jenis ikatan ini sangat menentukan sifat fisik dan kimia suatu senyawa.
Ikatan polar dan nonpolar terbentuk ketika atom-atom bergabung untuk membentuk molekul. Ikatan polar terjadi ketika atom-atom yang terlibat memiliki perbedaan keelektronegatifan, yang mengarah pada pemisahan muatan parsial positif dan negatif pada molekul. Sebaliknya, ikatan nonpolar terbentuk ketika atom-atom yang terlibat memiliki keelektronegatifan yang sama, menghasilkan distribusi muatan yang merata.
Pengertian Ikatan Polar dan Nonpolar
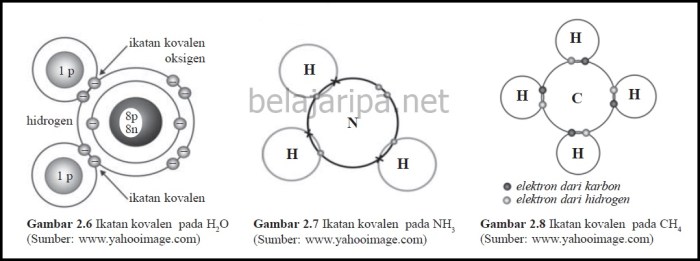
Ikatan kimia adalah gaya tarik menarik antara atom-atom atau ion-ion yang membentuk senyawa kimia. Berdasarkan perbedaan keelektronegatifan antar atom yang berikatan, ikatan kimia dapat dibedakan menjadi dua jenis, yaitu ikatan polar dan nonpolar.
Perbedaan Ikatan Polar dan Nonpolar
- Ikatan Polar: Terjadi ketika terdapat perbedaan keelektronegatifan antara atom-atom yang berikatan, sehingga terjadi pergeseran elektron ke arah atom yang lebih elektronegatif. Akibatnya, ikatan menjadi terpolarisasi, dengan satu ujung bermuatan positif (δ+) dan ujung lainnya bermuatan negatif (δ-).
- Ikatan Nonpolar: Terjadi ketika keelektronegatifan atom-atom yang berikatan sama, sehingga tidak terjadi pergeseran elektron. Akibatnya, ikatan tidak terpolarisasi dan tidak memiliki muatan parsial.
Contoh Senyawa
- Ikatan Polar: HCl, H2O, NH3
- Ikatan Nonpolar: H2, Cl2, CH4
Sifat Ikatan Polar dan Nonpolar
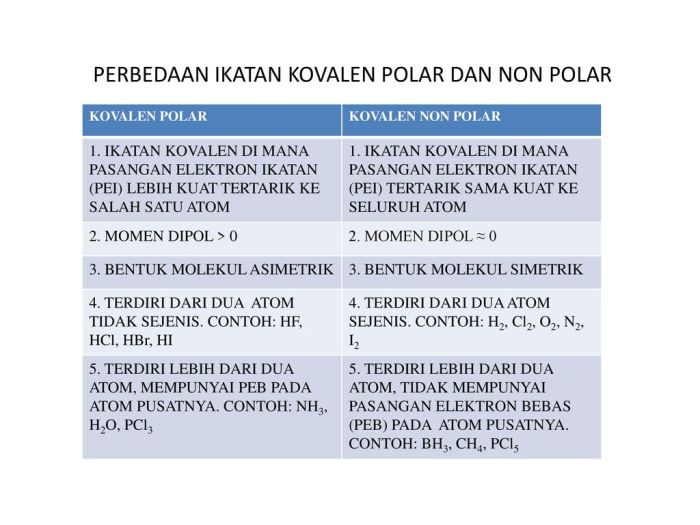
Ikatan polar dan nonpolar memiliki sifat yang berbeda, memengaruhi kelarutan, titik didih, dan titik leleh senyawa.
Kelarutan
- Senyawa polar larut dalam pelarut polar (seperti air).
- Senyawa nonpolar larut dalam pelarut nonpolar (seperti minyak).
Titik Didih dan Titik Leleh
Ikatan polar memiliki gaya antarmolekul yang lebih kuat (gaya dipol-dipol) daripada ikatan nonpolar. Gaya yang lebih kuat ini membutuhkan lebih banyak energi untuk diatasi, sehingga:
- Senyawa polar memiliki titik didih dan titik leleh yang lebih tinggi daripada senyawa nonpolar.
- Misalnya, air (polar) memiliki titik didih 100°C, sedangkan heksana (nonpolar) memiliki titik didih 69°C.
Gaya Intermolekul
Gaya intermolekul adalah gaya tarik-menarik antara molekul-molekul yang berdekatan. Gaya ini bertanggung jawab atas sifat fisik zat, seperti titik didih, titik leleh, dan viskositas.
Jenis Gaya Intermolekul
- Gaya van der Waals: Gaya tarik-menarik yang lemah antara molekul-molekul nonpolar. Terdiri dari:
- Gaya London: Gaya tarik-menarik sesaat yang disebabkan oleh polarisasi elektron.
- Gaya dipol-dipol terinduksi: Gaya tarik-menarik antara molekul polar dan nonpolar.
- Gaya dipol-dipol: Gaya tarik-menarik antara dua molekul polar.
- Ikatan hidrogen: Gaya tarik-menarik yang kuat antara molekul yang memiliki atom hidrogen terikat pada atom elektronegatif (F, O, N).
Kekuatan Gaya Intermolekul
Kekuatan gaya intermolekul bergantung pada jenis gaya dan polaritas molekul. Umumnya, ikatan hidrogen adalah gaya intermolekul terkuat, diikuti oleh gaya dipol-dipol, dipol-dipol terinduksi, dan gaya London.
Senyawa polar memiliki gaya intermolekul yang lebih kuat daripada senyawa nonpolar karena adanya momen dipol. Momen dipol adalah ukuran polaritas molekul.
Kekuatan gaya intermolekul mempengaruhi sifat fisik zat. Senyawa dengan gaya intermolekul yang kuat memiliki titik didih dan titik leleh yang lebih tinggi, serta viskositas yang lebih tinggi daripada senyawa dengan gaya intermolekul yang lemah.
Contoh Ikatan Polar dan Nonpolar
Ikatan polar dan nonpolar dapat ditemukan pada berbagai senyawa. Berikut adalah tabel yang menyajikan beberapa contoh senyawa dengan jenis ikatan dan sifat fisiknya:
Tabel Contoh Ikatan Polar dan Nonpolar
| Senyawa | Rumus Kimia | Jenis Ikatan | Sifat Fisik |
|---|---|---|---|
| Air | H2O | Polar | Cairan pada suhu kamar, titik didih tinggi |
| Metana | CH4 | Nonpolar | Gas pada suhu kamar, titik didih rendah |
| Amonia | NH3 | Polar | Gas pada suhu kamar, titik didih sedang |
| Oksigen | O2 | Nonpolar | Gas pada suhu kamar, titik didih sangat rendah |
| Natrium klorida | NaCl | Ionik (bukan polar) | Padatan pada suhu kamar, titik leleh tinggi |
Aplikasi Ikatan Polar dan Nonpolar
Sifat ikatan polar dan nonpolar sangat memengaruhi penggunaan senyawa dalam berbagai aplikasi kehidupan sehari-hari.
Aplikasi Senyawa Polar
- Pelarut: Senyawa polar seperti air dan alkohol digunakan sebagai pelarut untuk melarutkan zat polar lainnya. Hal ini karena sifat polarnya memungkinkan mereka berinteraksi dengan molekul polar melalui ikatan hidrogen atau interaksi dipol-dipol.
- Pembersih: Senyawa polar seperti sabun dan deterjen memiliki ujung hidrofilik (suka air) dan ujung hidrofobik (takut air). Ujung hidrofilik berinteraksi dengan air, sedangkan ujung hidrofobik berinteraksi dengan minyak dan kotoran. Interaksi ini memungkinkan sabun dan deterjen untuk melarutkan kotoran dan menghilangkannya dari permukaan.
Aplikasi Senyawa Nonpolar
- Bahan Pelumas: Senyawa nonpolar seperti minyak dan lemak digunakan sebagai pelumas untuk mengurangi gesekan antara permukaan. Sifat nonpolarnya mencegah mereka berinteraksi dengan molekul lain, sehingga menciptakan lapisan tipis yang mengurangi gesekan.
- Bahan Anti Air: Senyawa nonpolar seperti lilin dan Teflon digunakan sebagai bahan anti air karena sifatnya yang menolak air. Molekul air tidak dapat berinteraksi dengan molekul nonpolar, sehingga membentuk tetesan air yang mudah menggelinding dari permukaan.
Rancang Ilustrasi
Ilustrasi berikut menunjukkan perbedaan struktur molekul antara senyawa polar dan nonpolar.
Distribusi Muatan
- Senyawa polar memiliki distribusi muatan yang tidak merata, dengan satu ujung molekul bermuatan positif dan ujung lainnya bermuatan negatif.
- Senyawa nonpolar memiliki distribusi muatan yang merata, dengan tidak adanya pemisahan muatan.
Gaya Intermolekul
- Senyawa polar berinteraksi melalui gaya dipol-dipol, yang timbul dari interaksi antara ujung positif dan negatif dari molekul polar.
- Senyawa nonpolar berinteraksi melalui gaya dispersi London, yang timbul dari fluktuasi acak dalam distribusi elektron.
Penutupan

Dengan memahami sifat ikatan polar dan nonpolar, para ilmuwan dan peneliti dapat memprediksi dan memanipulasi sifat materi untuk berbagai aplikasi. Perbedaan dalam kelarutan, titik didih, dan titik leleh antara senyawa polar dan nonpolar telah mengarah pada perkembangan pelarut, bahan, dan teknologi baru yang tak terhitung jumlahnya.
Dengan demikian, pemahaman tentang ikatan kimia ini sangat penting untuk kemajuan di berbagai bidang, termasuk kimia, biologi, dan farmasi.
Pertanyaan yang Sering Diajukan
Apa perbedaan utama antara ikatan polar dan nonpolar?
Ikatan polar memiliki pemisahan muatan parsial, sedangkan ikatan nonpolar memiliki distribusi muatan yang merata.
Mengapa senyawa polar larut dalam air?
Air adalah pelarut polar, sehingga dapat membentuk ikatan hidrogen dengan senyawa polar.
Bagaimana ikatan polar memengaruhi titik didih suatu senyawa?
Gaya tarik-menarik yang kuat antara molekul polar meningkatkan titik didihnya.