Sel volta tersusun dari elektrode co dan k – Sel volta yang tersusun dari elektrode kobalt (Co) dan kalium (K) merupakan perangkat elektrokimia penting yang telah merevolusi berbagai industri. Dengan pemahaman tentang reaksi elektrokimia, potensial sel, dan aplikasi praktisnya, kita dapat memanfaatkan kekuatan sel volta untuk menghasilkan listrik dan memajukan teknologi.
Sel volta ini mengandalkan reaksi redoks yang terjadi pada elektrode Co dan K, yang menghasilkan arus listrik. Reaksi ini dipengaruhi oleh faktor-faktor seperti konsentrasi elektrolit dan potensial reduksi standar masing-masing elektrode.
Reaksi Elektrokimia

Sel volta tersusun dari dua elektrode yang terhubung melalui elektrolit. Reaksi elektrokimia yang terjadi pada sel volta melibatkan transfer elektron antara elektrode dan elektrolit, menghasilkan arus listrik.
Reaksi Reduksi
Pada elektrode Co, terjadi reaksi reduksi di mana ion Cu 2+dalam elektrolit menerima elektron dan tereduksi menjadi logam Cu.
Cu2++ 2 e –→ Cu
Reaksi Oksidasi
Pada elektrode K, terjadi reaksi oksidasi di mana logam K bereaksi dengan ion H 2O dalam elektrolit, melepaskan elektron dan membentuk ion K +dan gas H 2.
K + 2 H2O → 2 K ++ 2 OH –+ H 2
Peran Elektrolit
Elektrolit menyediakan medium untuk transfer ion antara elektrode. Ion positif bergerak menuju elektrode negatif (katode), sedangkan ion negatif bergerak menuju elektrode positif (anode).
Potensial Sel
Potensial sel volta adalah perbedaan potensial listrik antara dua elektrode dalam sel volta. Potensial ini dihasilkan oleh reaksi redoks spontan yang terjadi dalam sel.
Sel volta tersusun dari elektrode Co dan K merupakan salah satu contoh nyata hubungan timbal balik antara makhluk hidup. Hubungan timbal balik ini melibatkan pertukaran ion antara kedua elektrode, menghasilkan aliran elektron yang menghasilkan listrik. Seperti dalam hubungan timbal balik ekologis, di mana organisme bergantung satu sama lain untuk kelangsungan hidup, sel volta juga bergantung pada interaksi antara elektrode untuk menghasilkan energi listrik.
Persamaan untuk menghitung potensial sel volta adalah:
E°sel= E° katoda
E°anoda
di mana:
- E° seladalah potensial sel volta standar
- E° katodaadalah potensial reduksi standar katoda
- E° anodaadalah potensial oksidasi standar anoda
Faktor-faktor yang memengaruhi potensial sel meliputi:
- Konsentrasi reaktan dan produk
- Suhu
- Luas permukaan elektrode
Potensial Reduksi Standar
Potensial reduksi standar adalah ukuran kecenderungan suatu zat untuk mengalami reduksi. Potensial reduksi standar untuk Co dan K adalah:
| Reaksi | Potensial Reduksi Standar (V) |
|---|---|
| Co2+ + 2e– → Co | -0,28 |
| K+ + e– → K | -2,93 |
Penyusunan Sel Volta
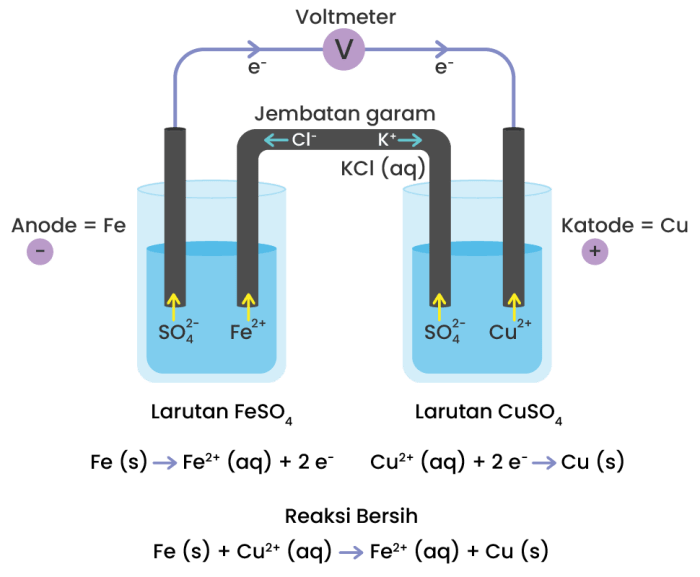
Sel volta adalah perangkat elektrokimia yang menghasilkan listrik dari reaksi kimia spontan. Sel volta terdiri dari dua elektroda yang terbuat dari bahan yang berbeda, yang terendam dalam larutan elektrolit.
Sel volta yang tersusun dari elektrode Co dan K menunjukkan reaksi elektrokimia yang menghasilkan arus listrik. Pertanyaan mengenai lokasi terjadinya dialog, where do you think the dialog takes place , dapat memberikan wawasan tentang konteks percakapan tersebut. Dalam sel volta, reaksi reduksi terjadi pada katode, yaitu elektrode Co, sementara reaksi oksidasi terjadi pada anode, yaitu elektrode K.
Reaksi-reaksi ini menciptakan aliran elektron yang menghasilkan arus listrik.
Komponen Utama Sel Volta
- Elektroda:Konduktor listrik yang melakukan kontak dengan larutan elektrolit. Elektroda dapat berupa logam, karbon, atau bahan konduktif lainnya.
- Larutan Elektrolit:Larutan yang mengandung ion yang dapat bergerak bebas, seperti asam, basa, atau garam.
- Jembatan Garam:Tabung berisi larutan elektrolit yang menghubungkan kedua larutan elektrolit dalam sel volta. Jembatan garam memungkinkan ion mengalir antara larutan, menjaga netralitas listrik.
Penyusunan Sel Volta dengan Elektroda Co dan K
Untuk menyusun sel volta dengan elektroda Co dan K, diperlukan:
- Batang logam Co dan K
- Larutan CoSO 4dan KCl
- Jembatan garam berisi larutan KNO 3
Susunan sel volta tersebut adalah sebagai berikut:
- Celupkan batang logam Co ke dalam larutan CoSO4, membentuk setengah sel Co.
- Celupkan batang logam K ke dalam larutan KCl, membentuk setengah sel K.
- Hubungkan kedua setengah sel dengan jembatan garam.
- Hubungkan terminal positif voltmeter ke elektroda Co dan terminal negatif ke elektroda K.
Prosedur Pengoperasian Sel Volta
Ketika sel volta beroperasi, reaksi redoks terjadi. Co teroksidasi di anoda, menghasilkan ion Co 2+dan elektron. Elektron mengalir melalui sirkuit eksternal ke katoda, di mana K direduksi menjadi logam K.
Reaksi keseluruhan dalam sel volta adalah:
Co + 2K+→ Co 2++ 2K
Aliran elektron dalam sirkuit eksternal menghasilkan arus listrik. Arus ini dapat digunakan untuk menyalakan perangkat listrik atau mengisi ulang baterai.
Aplikasi Sel Volta
Sel volta memiliki aplikasi praktis yang luas dalam kehidupan sehari-hari, menyediakan daya untuk berbagai perangkat dan proses industri.
Sel volta digunakan dalam berbagai aplikasi, seperti:
Baterai, Sel volta tersusun dari elektrode co dan k
- Baterai portabel: Memberikan daya untuk perangkat elektronik seperti ponsel, laptop, dan kamera.
- Baterai kendaraan: Menyalakan kendaraan listrik dan hibrida, menyediakan daya untuk menghidupkan mesin dan menggerakkan roda.
- Baterai cadangan: Menyediakan daya cadangan selama pemadaman listrik, memastikan kelangsungan operasi peralatan penting.
Industri
- Elektrolisis: Digunakan untuk memproduksi berbagai bahan kimia, seperti klorin, natrium hidroksida, dan aluminium.
- Pelapisan logam: Digunakan untuk melapisi logam lain dengan logam yang lebih tahan korosi atau meningkatkan sifat estetikanya.
- Pemurnian logam: Digunakan untuk memurnikan logam dengan menghilangkan kotoran dan meningkatkan kemurniannya.
Kelebihan dan Keterbatasan Sel Volta
Sel volta menawarkan beberapa keunggulan dibandingkan sumber energi lainnya:
- Keandalan: Sel volta dapat memberikan daya yang andal dan konsisten untuk waktu yang lama.
- Portabilitas: Sel volta dapat dengan mudah dipindahkan dan digunakan di berbagai lokasi.
- Ramah lingkungan: Sel volta tidak menghasilkan emisi berbahaya, menjadikannya pilihan yang lebih ramah lingkungan.
Namun, sel volta juga memiliki beberapa keterbatasan:
- Masa pakai terbatas: Sel volta memiliki masa pakai yang terbatas dan perlu diganti secara berkala.
- Pemeliharaan: Sel volta memerlukan pemeliharaan rutin untuk memastikan kinerja yang optimal.
- Biaya: Sel volta dapat relatif mahal untuk diproduksi dan dirawat.
Reaksi Samping dan Keselamatan: Sel Volta Tersusun Dari Elektrode Co Dan K

Sel volta merupakan perangkat elektrokimia yang mengonversi energi kimia menjadi energi listrik. Seperti sistem elektrokimia lainnya, sel volta dapat mengalami reaksi samping dan menimbulkan potensi bahaya keselamatan. Pemahaman yang baik tentang reaksi samping dan tindakan pencegahan keselamatan sangat penting untuk pengoperasian sel volta yang aman dan efisien.
Sel volta yang tersusun dari elektrode Co dan K menghasilkan arus listrik melalui reaksi redoks. Dalam konteks komunikasi jaringan, protokol HTTP, seperti protocol http mempunyai bagian antara lain , menyediakan kerangka kerja untuk pertukaran data. Sama seperti sel volta yang membutuhkan elektrode yang berbeda, protokol HTTP juga memiliki komponen yang berbeda, seperti header, body, dan status code, yang memungkinkan komunikasi yang efektif antara perangkat.
Reaksi Samping
Reaksi samping dalam sel volta dapat mengganggu proses elektrokimia yang diinginkan, sehingga mengurangi efisiensi dan meningkatkan risiko keselamatan. Beberapa reaksi samping umum meliputi:
- Polarisasi konsentrasi:Terjadi ketika konsentrasi reaktan atau produk pada permukaan elektroda berubah secara signifikan, menyebabkan perubahan potensial elektroda dan mengurangi arus yang dihasilkan.
- Polarisasi aktivasi:Mengacu pada hambatan kinetik pada transfer elektron pada permukaan elektroda, yang dapat membatasi laju reaksi elektrokimia.
- Korosi:Proses elektrokimia yang menyebabkan degradasi elektroda, biasanya melibatkan oksidasi atau reduksi logam.
- Evolusi gas:Pembentukan gas, seperti hidrogen atau oksigen, pada elektroda dapat menyebabkan gelembung yang mengganggu kontak elektroda dan mengurangi efisiensi sel.
Tindakan Pencegahan Keselamatan
Untuk memastikan pengoperasian sel volta yang aman, beberapa tindakan pencegahan keselamatan penting harus diperhatikan:
- Hindari hubungan pendek:Menghubungkan terminal sel volta secara langsung dapat menyebabkan arus berlebih dan panas berlebih, menimbulkan risiko kebakaran atau ledakan.
- Gunakan peralatan yang tepat:Sel volta harus dioperasikan menggunakan peralatan yang dirancang khusus, seperti voltmeter dan ammeter, untuk pengukuran yang akurat dan aman.
- Beri ventilasi yang memadai:Reaksi elektrokimia dapat menghasilkan gas berbahaya, seperti klorin atau hidrogen sulfida, yang memerlukan ventilasi yang memadai untuk mencegah penumpukan.
- Gunakan elektrolit yang tepat:Pemilihan elektrolit yang sesuai sangat penting untuk mencegah reaksi samping yang tidak diinginkan dan memastikan kinerja sel yang optimal.
Pembuangan Sel Volta
Setelah sel volta tidak lagi digunakan, pembuangannya harus dilakukan dengan benar untuk menghindari potensi bahaya lingkungan dan keselamatan. Beberapa metode pembuangan yang disarankan meliputi:
- Pembuangan limbah berbahaya:Sel volta yang mengandung bahan berbahaya, seperti logam berat atau elektrolit korosif, harus dibuang sebagai limbah berbahaya sesuai dengan peraturan setempat.
- Daur ulang:Beberapa komponen sel volta, seperti logam dan plastik, dapat didaur ulang untuk mengurangi dampak lingkungan.
- Pembuangan ke tempat sampah:Sel volta kecil yang tidak mengandung bahan berbahaya dapat dibuang ke tempat sampah biasa.
Dengan memahami reaksi samping yang potensial, mengambil tindakan pencegahan keselamatan yang tepat, dan membuang sel volta dengan benar, pengoperasian sel volta dapat dilakukan secara aman dan efisien, meminimalkan risiko bahaya dan melindungi lingkungan.
Pemungkas
Sel volta yang tersusun dari elektrode Co dan K terus memainkan peran penting dalam berbagai bidang, termasuk energi terbarukan, elektroplating, dan sintesis kimia. Memahami prinsip dan aplikasi sel volta ini sangat penting untuk kemajuan ilmu pengetahuan dan teknologi di masa depan.
Pertanyaan Umum (FAQ)
Apa reaksi redoks yang terjadi dalam sel volta ini?
Elektrode Co mengalami oksidasi (kehilangan elektron), sedangkan elektrode K mengalami reduksi (menerima elektron).
Bagaimana potensial sel dipengaruhi oleh konsentrasi elektrolit?
Potensial sel berkurang seiring bertambahnya konsentrasi elektrolit.
Apa saja keunggulan sel volta dibandingkan sumber energi lainnya?
Sel volta memiliki efisiensi tinggi, dapat diisi ulang, dan ramah lingkungan.
