Potensial sel, sebuah fenomena elektrokimia fundamental, memainkan peran penting dalam berbagai aplikasi kehidupan nyata. Konsep ini mengacu pada perbedaan potensial listrik antara dua elektroda dalam larutan elektrolit, yang mendorong aliran elektron dan memungkinkan terjadinya reaksi kimia. Pemahaman yang komprehensif tentang potensial sel sangat penting untuk berbagai bidang ilmiah dan teknologi.
Dalam artikel ini, kita akan membahas konsep potensial sel secara mendalam, menyelidiki faktor-faktor yang mempengaruhinya, metode pengukurannya, dan persamaan yang digunakan untuk menghitung nilainya. Selain itu, kami akan memberikan contoh soal yang komprehensif untuk menguji pemahaman pembaca tentang topik ini.
Konsep Potensial Sel
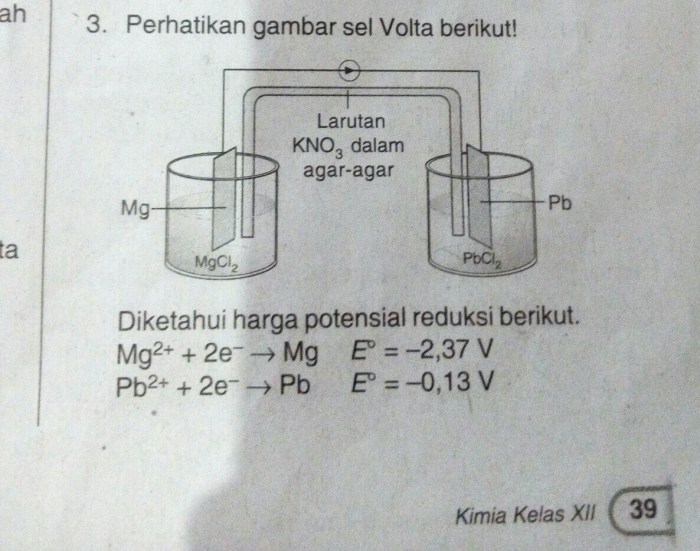
Potensial sel adalah perbedaan potensial listrik antara dua elektroda dalam larutan elektrolit. Perbedaan ini disebabkan oleh reaksi redoks yang terjadi pada elektroda. Elektroda yang mengalami reaksi oksidasi memiliki potensial lebih positif, sedangkan elektroda yang mengalami reaksi reduksi memiliki potensial lebih negatif.
Potensial sel diukur dalam satuan volt (V).Potensial sel memiliki banyak aplikasi dalam kehidupan sehari-hari. Misalnya, potensial sel digunakan dalam baterai untuk menghasilkan listrik. Baterai terdiri dari dua elektroda yang terhubung dengan larutan elektrolit. Ketika baterai digunakan, terjadi reaksi redoks pada elektroda, menghasilkan perbedaan potensial listrik yang dapat digunakan untuk menyalakan perangkat elektronik.
Jenis-Jenis Potensial Sel
Ada dua jenis utama potensial sel:*
-*Potensial Sel Galvani
Terjadi ketika dua elektroda yang berbeda dicelupkan ke dalam larutan elektrolit dan dihubungkan dengan konduktor.
-*Potensial Sel Elektrolisis
Terjadi ketika arus listrik dialirkan melalui larutan elektrolit, menyebabkan reaksi redoks pada elektroda.
Faktor-Faktor yang Mempengaruhi Potensial Sel
Potensial sel dipengaruhi oleh beberapa faktor, antara lain:*
-*Konsentrasi reaktan dan produk
Semakin tinggi konsentrasi reaktan, semakin besar potensial sel.
-
-*Suhu
Semakin tinggi suhu, semakin besar potensial sel.
-*Sifat elektroda
Potensial sel berbeda untuk elektroda yang berbeda.
Faktor-Faktor yang Mempengaruhi Potensial Sel
Potensial sel dipengaruhi oleh beberapa faktor, antara lain:
Konsentrasi Ion
Konsentrasi ion dalam larutan elektrolit memengaruhi potensial sel. Semakin tinggi konsentrasi ion, semakin tinggi potensial sel. Hal ini karena konsentrasi ion yang lebih tinggi menghasilkan jumlah ion yang lebih besar di permukaan elektroda, yang meningkatkan reaksi redoks dan menghasilkan potensial yang lebih tinggi.
Suhu
Suhu juga memengaruhi potensial sel. Semakin tinggi suhu, semakin tinggi potensial sel. Peningkatan suhu meningkatkan energi kinetik ion, memungkinkan mereka bergerak lebih cepat dan bereaksi lebih cepat di permukaan elektroda, yang menghasilkan potensial yang lebih tinggi.
Luas Permukaan Elektroda
Luas permukaan elektroda juga memengaruhi potensial sel. Semakin besar luas permukaan elektroda, semakin tinggi potensial sel. Hal ini karena luas permukaan yang lebih besar menyediakan lebih banyak tempat untuk reaksi redoks, menghasilkan potensial yang lebih tinggi.
Tabel Faktor yang Mempengaruhi Potensial Sel
| Faktor | Pengaruh ||—|—|| Konsentrasi Ion | Semakin tinggi konsentrasi ion, semakin tinggi potensial sel || Suhu | Semakin tinggi suhu, semakin tinggi potensial sel || Luas Permukaan Elektroda | Semakin besar luas permukaan elektroda, semakin tinggi potensial sel |
Pengukuran Potensial Sel
Pengukuran potensial sel sangat penting untuk memahami dan memprediksi perilaku reaksi elektrokimia. Terdapat beberapa metode yang dapat digunakan untuk mengukur potensial sel, antara lain:
Metode Voltmeter
- Metode voltmeter menggunakan voltmeter untuk mengukur beda potensial antara dua elektroda dalam sel elektrokimia.
- Voltmeter dihubungkan secara paralel dengan sel elektrokimia, sehingga arus tidak mengalir melalui voltmeter.
- Potensial sel diukur ketika reaksi elektrokimia mencapai kesetimbangan, sehingga tidak ada perubahan konsentrasi reaktan atau produk.
Metode Sel Konsentrasi
- Metode sel konsentrasi melibatkan penggunaan dua elektroda yang sama yang dicelupkan ke dalam larutan dengan konsentrasi yang berbeda.
- Perbedaan konsentrasi menyebabkan perbedaan potensial antara elektroda, yang dapat diukur menggunakan voltmeter.
- Metode ini digunakan untuk menentukan aktivitas ion atau konsentrasi spesies tertentu dalam larutan.
Metode Potensiometri
- Metode potensiometri menggunakan elektroda indikator yang sensitif terhadap ion tertentu untuk mengukur konsentrasi ion tersebut dalam larutan.
- Elektroda indikator dihubungkan ke elektroda referensi dengan potensial yang diketahui.
- Potensial sel diukur ketika elektroda indikator terpapar pada larutan yang mengandung ion yang akan diukur.
Selain metode di atas, terdapat juga metode lain yang dapat digunakan untuk mengukur potensial sel, seperti metode polarografi dan metode impedansi elektrokimia.
Diagram Sel Elektrokimia
Sel elektrokimia adalah perangkat yang digunakan untuk menghasilkan atau mengukur arus listrik melalui reaksi kimia. Sel elektrokimia terdiri dari beberapa komponen, antara lain:
- Elektroda: Elektroda adalah konduktor listrik yang berfungsi sebagai tempat terjadinya reaksi elektrokimia. Elektroda dapat berupa logam, karbon, atau bahan konduktif lainnya.
- Larutan elektrolit: Larutan elektrolit adalah larutan yang mengandung ion yang dapat bergerak bebas. Larutan elektrolit berfungsi sebagai jembatan ionik antara elektroda.
- Jembatan garam: Jembatan garam adalah tabung berisi larutan elektrolit yang menghubungkan dua setengah sel dalam sel elektrokimia. Jembatan garam memungkinkan ion mengalir antara setengah sel, tetapi mencegah pencampuran larutan.
- Voltmeter: Voltmeter digunakan untuk mengukur beda potensial antara dua elektroda dalam sel elektrokimia.
Persamaan Nernst
Persamaan Nernst adalah persamaan yang digunakan untuk menghitung potensial sel elektrokimia. Persamaan ini didasarkan pada hukum termodinamika kedua dan persamaan Gibbs-Helmholtz.
Rumus Persamaan Nernst
Rumus Persamaan Nernst adalah sebagai berikut:
E = E o – (RT/nF) ln Q
- E adalah potensial sel (dalam volt)
- Eo adalah potensial sel standar (dalam volt)
- R adalah konstanta gas ideal (8,314 J/mol K)
- T adalah suhu (dalam Kelvin)
- n adalah jumlah elektron yang ditransfer dalam reaksi redoks
- F adalah konstanta Faraday (96.485 C/mol)
- Q adalah hasil bagi konsentrasi reaktan dan produk, yang dinyatakan sebagai [produk]/[reaktan]
Penggunaan Persamaan Nernst
Persamaan Nernst digunakan untuk menghitung potensial sel dalam berbagai kondisi. Beberapa contoh penggunaan Persamaan Nernst meliputi:
- Menghitung potensial sel standar
- Menghitung potensial sel pada konsentrasi reaktan dan produk yang berbeda
- Menghitung perubahan potensial sel akibat perubahan suhu
Contoh Perhitungan Potensial Sel
Sebagai contoh, perhatikan reaksi redoks berikut:
Fe 2+ (aq) + 2e – → Fe(s)
Potensial sel standar untuk reaksi ini adalah -0,44 V. Jika konsentrasi Fe 2+ (aq) adalah 0,1 M, hitung potensial sel pada suhu 25°C.
Dengan menggunakan Persamaan Nernst, kita dapat menghitung potensial sel sebagai berikut:
E = E o – (RT/nF) ln Q
E = -0,44 V – (8,314 J/mol K – 298 K) / (2 – 96.485 C/mol) – ln (1/0,1)
E = -0,44 V – 0,029 V
E = -0,47 V
Jadi, potensial sel pada suhu 25°C adalah -0,47 V.
Aplikasi Potensial Sel
Potensial sel memiliki banyak aplikasi penting dalam berbagai bidang, termasuk baterai, elektroplating, dan sensor kimia.
Baterai
Baterai adalah perangkat elektrokimia yang menyimpan energi kimia dan mengubahnya menjadi energi listrik. Potensial sel memainkan peran penting dalam menentukan tegangan dan kapasitas baterai. Baterai dengan potensial sel yang lebih tinggi akan menghasilkan tegangan yang lebih tinggi dan menyimpan lebih banyak energi.
Elektroplating
Elektroplating adalah proses pelapisan logam pada permukaan logam lain menggunakan arus listrik. Potensial sel digunakan untuk mengontrol laju dan ketebalan pelapisan. Potensial sel yang lebih tinggi akan menghasilkan laju pelapisan yang lebih cepat dan lapisan yang lebih tebal.
Sensor Kimia
Potensial sel dapat digunakan untuk mendeteksi keberadaan dan konsentrasi zat kimia tertentu. Dalam sensor kimia, elektroda dengan potensial sel yang diketahui direndam dalam larutan yang mengandung zat kimia target. Jika zat kimia target hadir, itu akan bereaksi dengan elektroda dan menyebabkan perubahan potensial sel, yang dapat diukur dan digunakan untuk menentukan konsentrasi zat kimia.
Contoh Soal

Potensial sel adalah gaya gerak listrik yang dihasilkan oleh reaksi redoks dalam sel elektrokimia. Untuk menguji pemahaman tentang konsep ini, berikut adalah contoh soal:
Menghitung Potensial Sel
Sebuah sel elektrokimia tersusun dari elektroda tembaga (Cu) dan elektroda seng (Zn). Elektroda tembaga dicelupkan ke dalam larutan CuSO4 1 M, sedangkan elektroda seng dicelupkan ke dalam larutan ZnSO4 1 M. Tentukan potensial sel dari sel ini.
Ringkasan Penutup
Secara keseluruhan, konsep potensial sel sangat penting untuk memahami berbagai proses elektrokimia. Persamaan Nernst menyediakan alat yang ampuh untuk menghitung potensial sel dalam berbagai kondisi, yang memungkinkan kita untuk memprediksi dan mengendalikan reaksi kimia yang terjadi dalam sel elektrokimia. Pemahaman yang baik tentang topik ini sangat penting bagi para peneliti, insinyur, dan praktisi di bidang elektrokimia dan disiplin terkait.
Bagian Pertanyaan Umum (FAQ)
Apa saja faktor yang mempengaruhi potensial sel?
Konsentrasi ion, suhu, dan luas permukaan elektroda.
Bagaimana cara mengukur potensial sel?
Dengan menggunakan voltmeter yang terhubung ke sel elektrokimia.
Apa saja aplikasi potensial sel?
Baterai, elektroplating, dan sensor kimia.
