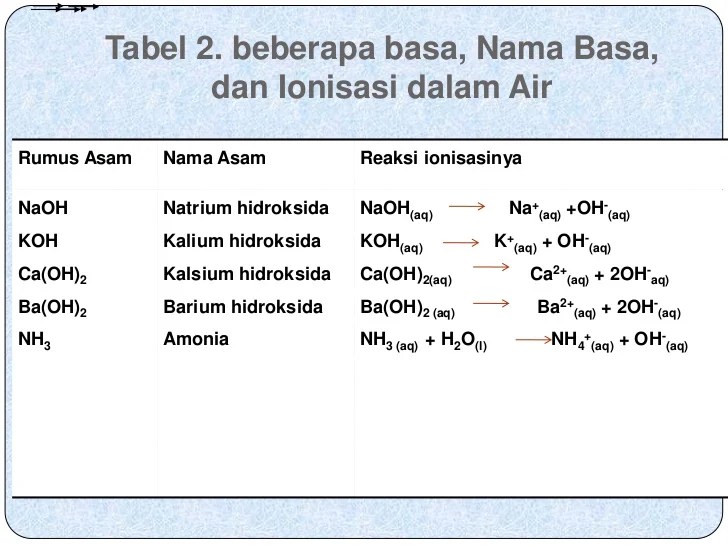
Dalam kimia, ionisasi merupakan proses pelepasan ion oleh suatu zat. Reaksi ionisasi basa lemah memainkan peran penting dalam berbagai aspek kimia, mulai dari kesetimbangan asam-basa hingga aplikasi praktis dalam kehidupan sehari-hari. Artikel ini akan mengulas konsep, jenis, dan aplikasi reaksi ionisasi basa lemah, memberikan wawasan mendalam tentang topik penting ini.
Basa lemah adalah zat yang mengalami ionisasi parsial dalam larutan berair, melepaskan ion hidroksida (OH-) dan kation. Reaksi ionisasi basa lemah diwakili oleh persamaan kimia berikut: B(aq) + H2O(l) ⇌ BH+(aq) + OH-(aq).
Reaksi Ionisasi Basa Lemah
Ionisasi basa lemah merupakan proses kimia di mana basa lemah bereaksi dengan air untuk menghasilkan ion hidronium (H 3 O + ) dan ion basa konjugasi.
Reaksi ionisasi basa lemah dapat dinyatakan dalam persamaan kimia berikut:
B + H 2 O ⇌ BH + + OH –
Di mana B adalah basa lemah, BH + adalah basa konjugasi, dan OH – adalah ion hidroksida.
Faktor-faktor yang Mempengaruhi Derajat Ionisasi Basa Lemah
- Kekuatan Basa: Semakin kuat basa, semakin tinggi derajat ionisasinya.
- Konsentrasi Basa: Semakin tinggi konsentrasi basa, semakin tinggi derajat ionisasinya.
- Suhu: Semakin tinggi suhu, semakin tinggi derajat ionisasinya.
- Kehadiran Ion Bersama: Kehadiran ion yang sama dalam larutan dapat menurunkan derajat ionisasi basa lemah.
Jenis-jenis Basa Lemah
Basa lemah adalah basa yang terionisasi sebagian dalam larutan, menghasilkan ion hidroksida (OH-) dan basa konjugasinya. Terdapat beberapa jenis basa lemah, yang masing-masing memiliki karakteristik yang berbeda.
Basa Amina
- Amina adalah senyawa organik yang mengandung atom nitrogen dengan sepasang elektron bebas.
- Contoh: amonia (NH3), metilamina (CH3NH2), anilin (C6H5NH2)
- Basa amina cenderung lebih lemah daripada basa hidroksida, tetapi lebih kuat daripada basa amida.
Basa Amida
- Amida adalah senyawa organik yang mengandung gugus fungsi
-CONH2. - Contoh: asetamida (CH3CONH2), benzamida (C6H5CONH2)
- Basa amida adalah basa yang sangat lemah, biasanya dengan nilai pKb di atas 10.
Basa Karboksilat
- Karboksilat adalah anion dari asam karboksilat.
- Contoh: asetat (CH3COO-), benzoat (C6H5COO-)
- Basa karboksilat memiliki kekuatan basa yang bervariasi tergantung pada struktur asam karboksilat induknya.
Basa Fosfat
- Fosfat adalah anion dari asam fosfat.
- Contoh: fosfat monobasa (H2PO4-), fosfat dibasa (HPO42-), fosfat tribasa (PO43-)
- Basa fosfat memiliki beberapa tahap disosiasi, yang menghasilkan kekuatan basa yang bervariasi.
Konstanta Ionisasi Basa Lemah
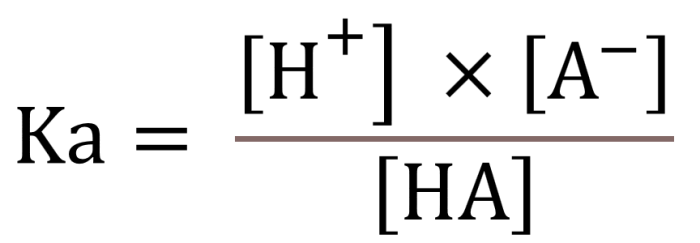
Konstanta ionisasi basa lemah (Kb) adalah ukuran kekuatan basa dalam larutan berair. Ini mewakili kemampuan basa untuk menerima proton (H+) dan membentuk basa konjugasinya. Semakin besar nilai Kb, semakin kuat basa.
Metode untuk Menentukan Kb Basa Lemah
Nilai Kb basa lemah dapat ditentukan menggunakan beberapa metode, termasuk:
- Pengukuran pH larutan basa
- Titrasi dengan asam standar
- Konduktivitas listrik
- Spektroskopi UV-Vis
Tabel Nilai Kb untuk Berbagai Basa Lemah
Berikut ini adalah tabel yang menunjukkan nilai Kb untuk berbagai basa lemah:
| Basa | Kb |
|---|---|
| Amonia (NH3) | 1,8 x 10^-5 |
| Piridina (C5H5N) | 1,7 x 10^-9 |
| Anilin (C6H5NH2) | 4,3 x 10^-10 |
| Metilamina (CH3NH2) | 4,4 x 10^-4 |
| Dimetilamina ((CH3)2NH) | 5,9 x 10^-4 |
Aplikasi Reaksi Ionisasi Basa Lemah

Reaksi ionisasi basa lemah memainkan peran penting dalam berbagai aplikasi kimia analitik, salah satunya adalah dalam penentuan pH larutan. Larutan basa lemah dapat digunakan sebagai standar dalam titrasi asam-basa, di mana titik ekivalen ditentukan oleh perubahan pH yang tajam. Selain itu, basa lemah juga dapat digunakan dalam penyangga, yang mempertahankan kisaran pH yang relatif sempit saat asam atau basa ditambahkan.
Aplikasi dalam Penyangga
Penyangga adalah larutan yang dapat menahan perubahan pH yang signifikan saat asam atau basa ditambahkan. Penyangga terdiri dari basa lemah dan garamnya. Ketika asam ditambahkan ke larutan penyangga, basa lemah bereaksi dengan ion hidrogen (H+) untuk membentuk asam konjugasinya, sehingga mencegah penurunan pH yang drastis.
Demikian pula, ketika basa ditambahkan, asam konjugasi basa lemah bereaksi dengan ion hidroksida (OH-) untuk membentuk basa lemah, sehingga mencegah peningkatan pH yang drastis.
Contoh Praktis
Salah satu contoh praktis penggunaan reaksi ionisasi basa lemah dalam kehidupan sehari-hari adalah dalam industri makanan. Natrium bikarbonat (NaHCO3), yang merupakan basa lemah, digunakan sebagai pengembang dalam memanggang. Ketika dipanaskan, NaHCO3 terurai menjadi karbon dioksida (CO2), yang menyebabkan adonan mengembang.
Selain itu, basa lemah juga digunakan dalam produk pembersih rumah tangga untuk menetralkan asam dan menghilangkan bau.
Terakhir
Reaksi ionisasi basa lemah sangat penting dalam berbagai bidang kimia dan memiliki aplikasi praktis yang luas. Memahami konsep dan faktor yang memengaruhi reaksi ini sangat penting untuk mengontrol kesetimbangan asam-basa, merancang penyangga, dan memecahkan masalah kimia yang kompleks. Studi lebih lanjut tentang reaksi ionisasi basa lemah akan terus memberikan wawasan berharga tentang perilaku kimia dan membuka kemungkinan baru untuk aplikasi inovatif.
Tanya Jawab (Q&A)
Apa itu konstanta ionisasi basa lemah (Kb)?
Konstanta ionisasi basa lemah (Kb) adalah ukuran kekuatan basa yang mengukur tingkat ionisasinya dalam larutan. Semakin tinggi nilai Kb, semakin kuat basa.
Bagaimana cara menentukan nilai Kb untuk basa lemah?
Nilai Kb dapat ditentukan secara eksperimental dengan mengukur pH larutan basa lemah dan menggunakan persamaan Henderson-Hasselbalch.
Apa saja aplikasi reaksi ionisasi basa lemah dalam kehidupan sehari-hari?
Reaksi ionisasi basa lemah digunakan dalam berbagai produk rumah tangga, seperti sabun, deterjen, dan obat-obatan, untuk mengatur pH dan memberikan sifat tertentu.