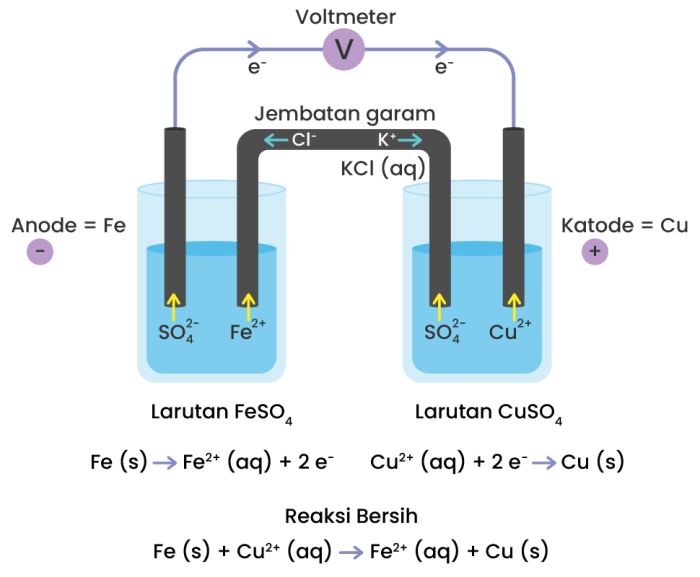
Rangkaian sel volta, juga dikenal sebagai sel galvanik, adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Sel-sel ini sangat penting dalam berbagai aplikasi praktis, mulai dari baterai hingga sistem tenaga surya. Untuk memahami cara kerja sel volta, sangat penting untuk memvisualisasikan rangkaiannya.
Dalam artikel ini, kita akan menyajikan gambar rangkaian sel volta yang komprehensif, memberikan pemahaman yang jelas tentang komponen dan prinsip kerja mereka. Gambar-gambar ini akan berfungsi sebagai panduan visual yang berharga untuk memahami konsep sel volta dan aplikasinya.
Pengertian Rangkaian Sel Volta
Rangkaian sel volta, juga dikenal sebagai sel galvani, adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Prinsip kerjanya didasarkan pada reaksi redoks, di mana satu zat dioksidasi (kehilangan elektron) dan zat lain direduksi (mendapatkan elektron).
Dalam rangkaian sel volta sederhana, terdapat dua elektroda (anoda dan katoda) yang terendam dalam larutan elektrolit. Anoda adalah tempat oksidasi terjadi, sedangkan katoda adalah tempat reduksi terjadi. Kedua elektroda dihubungkan oleh konduktor logam dan voltmeter untuk mengukur tegangan yang dihasilkan.
Contoh Rangkaian Sel Volta Sederhana
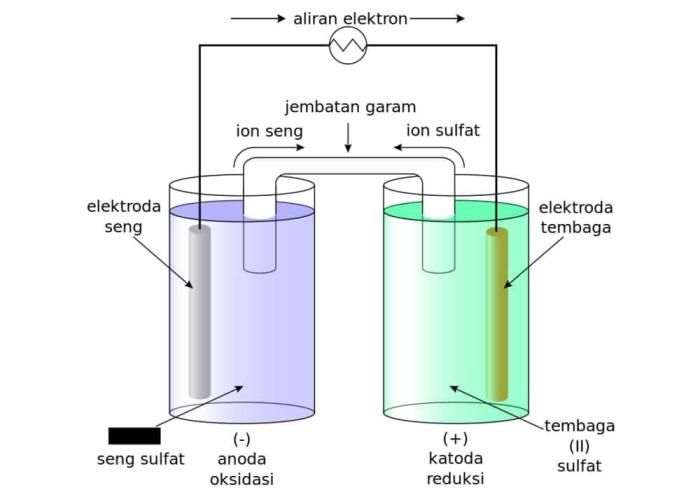
- Sel Daniel: Terdiri dari elektroda tembaga (anoda) dan elektroda seng (katoda) yang terendam dalam larutan seng sulfat dan tembaga sulfat.
- Sel Weston: Elektroda kadmium (anoda) dan elektroda merkuri (katoda) yang terendam dalam larutan kadmium sulfat dan merkuri sulfat.
- Sel Volta: Elektroda seng (anoda) dan elektroda tembaga (katoda) yang terendam dalam larutan asam sulfat.
Komponen Rangkaian Sel Volta
Rangkaian sel volta adalah rangkaian listrik yang menghasilkan arus listrik dari reaksi kimia spontan. Rangkaian ini terdiri dari beberapa komponen utama, yaitu elektroda, elektrolit, dan jembatan garam.
Elektroda
- Elektroda adalah konduktor listrik yang bersentuhan dengan elektrolit.
- Terdapat dua elektroda dalam rangkaian sel volta, yaitu anoda dan katoda.
- Anoda adalah elektroda tempat terjadi reaksi oksidasi, sedangkan katoda adalah elektroda tempat terjadi reaksi reduksi.
Elektrolit
- Elektrolit adalah larutan atau lelehan yang mengandung ion bebas.
- Elektrolit berfungsi sebagai penghantar ion antara elektroda.
- Ion-ion dalam elektrolit bergerak menuju elektroda yang sesuai untuk bereaksi.
Jembatan Garam
- Jembatan garam adalah tabung berbentuk U yang diisi dengan larutan elektrolit.
- Jembatan garam menghubungkan larutan dalam dua setengah sel.
- Jembatan garam berfungsi untuk menjaga kenetralan listrik larutan dan mencegah penumpukan muatan pada elektroda.
Jenis-Jenis Rangkaian Sel Volta
Rangkaian sel volta dapat diklasifikasikan menjadi beberapa jenis berdasarkan sifat reaksinya. Dua jenis utama rangkaian sel volta adalah:
Sel Volta Konsentrasi
Sel volta konsentrasi menghasilkan listrik dari perbedaan konsentrasi zat terlarut dalam larutan elektrolit. Elektroda dalam sel volta konsentrasi terbuat dari bahan yang sama, tetapi konsentrasi zat terlarut pada kedua elektroda berbeda. Perbedaan konsentrasi ini menciptakan perbedaan potensial yang mendorong aliran elektron.
Sel Volta Sel Bahan Bakar
Sel volta sel bahan bakar menghasilkan listrik melalui reaksi kimia antara bahan bakar dan oksidator. Elektroda dalam sel bahan bakar biasanya terbuat dari bahan yang berbeda, seperti hidrogen dan oksigen. Reaksi kimia antara bahan bakar dan oksidator menghasilkan elektron yang mengalir melalui rangkaian eksternal, menghasilkan listrik.
Aplikasi Rangkaian Sel Volta
Rangkaian sel volta memiliki berbagai aplikasi praktis dalam kehidupan sehari-hari, antara lain:
Baterai
- Baterai sel kering digunakan dalam perangkat elektronik portabel, seperti senter, jam tangan, dan mainan.
- Baterai timbal-asam digunakan dalam kendaraan bermotor sebagai sumber energi untuk menghidupkan mesin dan menyalakan lampu.
- Baterai lithium-ion digunakan dalam perangkat elektronik seperti laptop, ponsel, dan kamera.
Aki
Aki, juga dikenal sebagai baterai isi ulang, digunakan dalam kendaraan bermotor untuk menyimpan energi listrik dan menyediakan daya saat dibutuhkan, seperti saat menghidupkan mesin atau menyalakan lampu.
Sistem Tenaga Surya
Panel surya mengubah energi cahaya matahari menjadi energi listrik melalui proses yang disebut efek fotovoltaik. Sel volta digunakan dalam sistem tenaga surya untuk mengubah energi listrik yang dihasilkan menjadi arus listrik searah (DC) yang dapat disimpan dalam baterai atau digunakan untuk menyalakan peralatan.
Perhitungan pada Rangkaian Sel Volta
Rangkaian sel volta menghasilkan listrik dari reaksi kimia spontan. Perhitungan pada rangkaian ini meliputi tegangan sel, arus, dan kapasitas.
Rumus dan Persamaan
Tegangan sel (E) dihitung menggunakan persamaan Nernst:“`E = E°
(RT/nF)ln(Q)
“`di mana:
- E° adalah tegangan sel standar
- R adalah konstanta gas (8,314 J/mol K)
- T adalah suhu (Kelvin)
- n adalah jumlah elektron yang ditransfer
- F adalah konstanta Faraday (96.485 C/mol)
- Q adalah hasil bagi konsentrasi reaktan dan produk
Arus (I) dihitung menggunakan Hukum Ohm:“`I = E/R“`di mana:
R adalah resistansi total rangkaian
Kapasitas (Q) dihitung menggunakan persamaan:“`Q = nIt“`di mana:
- n adalah jumlah elektron yang ditransfer
- I adalah arus
- t adalah waktu
Contoh Soal
Soal:Hitung tegangan sel volta yang tersusun dari elektroda Zn dan Cu, dengan konsentrasi ion Zn2+ sebesar 0,1 M dan konsentrasi ion Cu2+ sebesar 0,01 M. Suhu ruangan adalah 25°C.Langkah-langkah:
1. Tentukan tegangan sel standar
E° = 1,10 V
2. Hitung hasil bagi konsentrasi
Q = [Zn2+]/[Cu2+] = 10
3. Masukkan nilai ke persamaan Nernst
E = 1,10 V(0,0257 V/mol K)ln(10)
4. Hitung tegangan sel
E ≈ 1,05 VCatatan:Persamaan dan rumus yang digunakan dalam perhitungan ini merupakan persamaan umum yang berlaku untuk rangkaian sel volta secara umum. Nilai spesifik dapat bervariasi tergantung pada reaksi kimia yang terjadi dan kondisi spesifik rangkaian.
Faktor yang Mempengaruhi Kinerja Rangkaian Sel Volta
Kinerja rangkaian sel volta dipengaruhi oleh beberapa faktor, antara lain:
Konsentrasi Elektrolit
Semakin tinggi konsentrasi elektrolit, semakin tinggi tegangan sel dan arus yang dihasilkan. Hal ini disebabkan oleh peningkatan jumlah ion yang tersedia untuk bereaksi pada elektroda, sehingga mempercepat laju reaksi redoks.
Luas Permukaan Elektroda
Luas permukaan elektroda juga memengaruhi kinerja rangkaian sel volta. Semakin besar luas permukaan elektroda, semakin banyak reaksi redoks yang dapat terjadi, sehingga menghasilkan tegangan sel dan arus yang lebih tinggi.
Suhu
Suhu yang lebih tinggi umumnya meningkatkan tegangan sel dan arus rangkaian sel volta. Peningkatan suhu meningkatkan aktivitas ion dan mempercepat laju reaksi redoks. Namun, perlu dicatat bahwa pada suhu yang sangat tinggi, beberapa reaksi redoks mungkin menjadi tidak menguntungkan, sehingga menurunkan kinerja rangkaian sel volta.
Perawatan dan Pemeliharaan Rangkaian Sel Volta
Merawat dan memelihara rangkaian sel volta sangat penting untuk memastikan masa pakai yang lama dan kinerja yang optimal. Tindakan pencegahan tertentu perlu diambil untuk menghindari kerusakan atau kegagalan sel.
Pemeriksaan dan Penggantian Elektroda
Elektroda adalah komponen penting dalam rangkaian sel volta. Pemeriksaan dan penggantian elektroda secara teratur sangat penting untuk memastikan kinerja yang optimal. Elektroda harus diperiksa secara berkala dari korosi, kerusakan, atau penumpukan kotoran. Elektroda yang rusak atau aus harus segera diganti.
Pengelolaan Larutan Elektrolit
Larutan elektrolit adalah media yang memungkinkan aliran ion dalam sel volta. Larutan elektrolit harus dikelola dengan hati-hati untuk memastikan konsentrasi ion yang optimal. Larutan harus diperiksa secara teratur dari penguapan atau kontaminasi. Jika perlu, larutan harus diganti atau ditambahkan untuk mempertahankan konsentrasi yang tepat.
Pembersihan dan Pemeliharaan
Rangkaian sel volta harus dibersihkan dan dirawat secara teratur untuk mencegah penumpukan kotoran atau korosi. Terminal dan sambungan harus diperiksa dan dibersihkan dari kotoran atau oksidasi. Bagian luar sel juga harus dibersihkan untuk mencegah penumpukan debu atau kotoran.
Penyimpanan yang Benar
Saat tidak digunakan, rangkaian sel volta harus disimpan di tempat yang kering dan sejuk. Elektroda harus dilepas dan disimpan secara terpisah untuk mencegah kerusakan. Larutan elektrolit harus dibuang dengan benar sesuai dengan peraturan setempat.
Tindakan Pencegahan Keselamatan
Saat menangani rangkaian sel volta, tindakan pencegahan keselamatan harus diperhatikan. Elektrolit dapat bersifat korosif dan beracun. Kenakan sarung tangan dan pelindung mata saat bekerja dengan sel volta. Jangan pernah menyentuh elektroda atau terminal dengan tangan kosong.
Gambar Ilustrasi Rangkaian Sel Volta

Sel volta adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Berbagai jenis rangkaian sel volta dapat dibuat, masing-masing dengan komponen dan prinsip kerja yang berbeda.
Rangkaian Sel Volta Sederhana
- Komponen:
- Dua elektroda (anoda dan katoda)
- Larutan elektrolit
- Penghubung logam
- Prinsip Kerja: Reaksi redoks terjadi pada anoda dan katoda, menghasilkan aliran elektron melalui penghubung logam dan menghasilkan arus listrik.
Rangkaian Sel Volta dengan Jembatan Garam
- Komponen:
- Dua setengah sel
- Jembatan garam
- Prinsip Kerja: Jembatan garam memungkinkan pergerakan ion antara dua setengah sel, menjaga netralitas listrik dan mencegah penumpukan muatan.
Rangkaian Sel Volta dengan Elektroda Referensi
- Komponen:
- Sel volta sederhana
- Elektroda referensi (misalnya, elektroda kalomel)
- Prinsip Kerja: Elektroda referensi menyediakan potensial referensi yang stabil, memungkinkan pengukuran potensial elektroda sel volta secara akurat.
Cara Membuat Rangkaian Sel Volta Sederhana
Sel volta adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Rangkaian sel volta sederhana dapat dibuat di laboratorium menggunakan bahan dan peralatan yang mudah diperoleh.
Bahan dan Peralatan
- Dua elektroda logam (misalnya, tembaga dan seng)
- Larutan elektrolit (misalnya, larutan asam sulfat)
- Voltmeter
- Kabel penghubung
- Bejana
Prosedur
- Tuang larutan elektrolit ke dalam dua bejana.
- Masukkan elektroda logam ke dalam masing-masing bejana.
- Hubungkan elektroda positif (anoda) ke elektroda negatif (katoda) menggunakan kabel penghubung.
- Hubungkan voltmeter ke elektroda untuk mengukur tegangan yang dihasilkan.
- Amati bacaan voltmeter dan catat nilai tegangan.
Eksperimen dengan Rangkaian Sel Volta
Rangkaian sel volta memainkan peran penting dalam konversi energi kimia menjadi energi listrik. Untuk mengoptimalkan kinerja rangkaian ini, pemahaman tentang faktor-faktor yang memengaruhi kinerjanya sangat penting.
Perancangan Eksperimen
Perancangan eksperimen yang tepat sangat penting untuk menyelidiki faktor-faktor yang memengaruhi kinerja rangkaian sel volta. Variabel yang akan diuji meliputi konsentrasi larutan elektrolit, luas permukaan elektroda, dan jarak antar elektroda.
Prosedur eksperimen meliputi penyiapan rangkaian sel volta dengan variabel yang dikendalikan. Tegangan rangkaian kemudian diukur dan dianalisis menggunakan metode statistik.
Analisis Data
Analisis data melibatkan penggunaan regresi linier untuk menentukan hubungan antara variabel yang diuji dan tegangan rangkaian. Koefisien korelasi dan nilai p digunakan untuk menilai kekuatan dan signifikansi hubungan tersebut.
Kesimpulan
Gambar rangkaian sel volta yang disajikan dalam artikel ini memberikan gambaran mendalam tentang prinsip kerja dan aplikasi praktis sel-sel ini. Dengan memvisualisasikan komponen dan interkoneksinya, kita dapat lebih menghargai pentingnya sel volta dalam berbagai bidang, termasuk penyimpanan energi, konversi energi, dan penelitian elektrokimia.
Pertanyaan Umum (FAQ)
Apa itu sel volta konsentrasi?
Sel volta konsentrasi menghasilkan listrik dari perbedaan konsentrasi elektrolit dalam dua setengah sel.
Apa aplikasi sel volta sel bahan bakar?
Sel volta sel bahan bakar menghasilkan listrik dengan menggabungkan hidrogen dan oksigen untuk membentuk air.
Apa faktor yang mempengaruhi tegangan sel volta?
Konsentrasi elektrolit, luas permukaan elektroda, dan suhu dapat mempengaruhi tegangan sel volta.