Dalam dunia kimia, titrasi asam basa merupakan teknik penting yang digunakan untuk menentukan konsentrasi zat yang tidak diketahui dengan cara menambahkan larutan standar secara bertahap. Proses ini sangat umum dilakukan dalam berbagai bidang, mulai dari industri hingga penelitian ilmiah.
Prinsip titrasi asam basa bergantung pada reaksi netralisasi, di mana asam dan basa bereaksi membentuk garam dan air. Indikator berperan penting dalam menentukan titik ekivalen, yaitu titik di mana jumlah asam dan basa yang bereaksi sama persis.
Pengertian Titrasi Asam Basa
Titrasi asam basa adalah teknik analisis kuantitatif yang digunakan untuk menentukan konsentrasi suatu asam atau basa dalam larutan. Tujuan utama titrasi asam basa adalah untuk menetralkan asam dan basa dengan reaksi kimia sehingga mencapai titik ekivalen, yaitu titik di mana jumlah mol asam sama dengan jumlah mol basa.
Reaksi netralisasi ini menghasilkan garam dan air.
Reaksi Titrasi Asam Basa Sederhana
Contoh reaksi titrasi asam basa sederhana adalah reaksi antara asam kuat, seperti asam klorida (HCl), dan basa kuat, seperti natrium hidroksida (NaOH):“`HCl + NaOH → NaCl + H 2 O“`Dalam reaksi ini, HCl berperan sebagai asam, sedangkan NaOH berperan sebagai basa.
NaCl adalah garam yang dihasilkan dari reaksi, dan H 2 O adalah air.
Prinsip Titrasi Asam Basa
Titrasi asam basa adalah teknik analitik yang digunakan untuk menentukan konsentrasi asam atau basa dalam suatu larutan. Prinsip dasar titrasi asam basa adalah reaksi netralisasi, di mana asam bereaksi dengan basa untuk menghasilkan garam dan air.
Titik ekivalen dalam titrasi asam basa adalah titik di mana jumlah ekivalen asam dan basa yang bereaksi adalah sama. Pada titik ekivalen, larutan akan bersifat netral, artinya tidak ada asam atau basa yang tersisa.
Peran Indikator dalam Titrasi Asam Basa
Indikator adalah zat yang berubah warna pada titik ekivalen. Indikator dipilih sehingga titik ekivalen ditunjukkan oleh perubahan warna yang mudah diamati. Misalnya, fenolftalein adalah indikator yang berubah dari tidak berwarna menjadi merah muda pada titik ekivalen dalam titrasi asam kuat dengan basa kuat.
Prosedur Titrasi Asam Basa
Titrasi asam basa adalah teknik kuantitatif yang digunakan untuk menentukan konsentrasi larutan asam atau basa. Prosedur ini melibatkan penambahan larutan dengan konsentrasi yang diketahui (titran) ke dalam larutan dengan konsentrasi yang tidak diketahui (analit) hingga titik ekivalen tercapai.
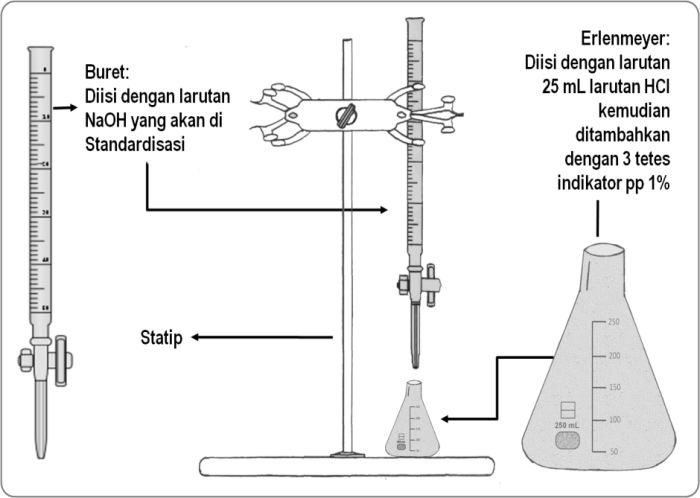
Peralatan dan Prosedur
- Buret
- Erlenmeyer
- Pipet tetes
- Indikator
- Larutan standar
Langkah-langkah titrasi asam basa meliputi:
- Pipet analit ke dalam Erlenmeyer.
- Tambahkan beberapa tetes indikator.
- Isi buret dengan titran.
- Tambahkan titran ke analit secara perlahan sambil mengaduk terus.
- Hentikan penambahan titran saat perubahan warna indikator menunjukkan titik ekivalen.
- Catat volume titran yang digunakan.
Penting untuk menggunakan peralatan yang tepat dan mengikuti prosedur dengan benar untuk memastikan akurasi hasil titrasi.
Perhitungan Titrasi Asam Basa
Persamaan Kimia
Konsentrasi zat yang tidak diketahui dapat dihitung menggunakan persamaan kimia berikut:
- M1V1 = M2V2
di mana:
- M1 adalah konsentrasi larutan standar (diketahui)
- V1 adalah volume larutan standar yang digunakan
- M2 adalah konsentrasi larutan yang tidak diketahui (dicari)
- V2 adalah volume larutan yang tidak diketahui
Contoh Perhitungan
Misalkan kita memiliki larutan standar NaOH 0,1 M dan kita ingin menentukan konsentrasi larutan HCl yang tidak diketahui. Kita menambahkan 25,0 mL larutan NaOH ke larutan HCl dan mencapai titik akhir titrasi.
Persamaan kimia yang digunakan:
- NaOH + HCl → NaCl + H2O
Dari persamaan kimia, kita dapat melihat bahwa 1 mol NaOH bereaksi dengan 1 mol HCl.
Menggunakan persamaan konsentrasi, kita dapat menghitung konsentrasi larutan HCl:
- 0,1 M x 25,0 mL = M2 x V2
Karena volume larutan HCl tidak diketahui, kita dapat mengasumsikan V 2 = 100 mL (volume yang umum digunakan dalam titrasi).
- 0,1 M x 25,0 mL = M2 x 100 mL
- M2 = 0,025 M
Oleh karena itu, konsentrasi larutan HCl yang tidak diketahui adalah 0,025 M.
Aplikasi Titrasi Asam Basa
Titrasi asam basa memiliki berbagai aplikasi penting dalam industri, penelitian, dan kehidupan sehari-hari.
Dalam Industri
- Kontrol kualitas: Titrasi digunakan untuk memastikan konsentrasi bahan kimia dalam produk industri, seperti makanan, obat-obatan, dan bahan kimia industri.
- Penelitian dan pengembangan: Titrasi membantu para ilmuwan menentukan sifat dan konsentrasi zat baru.
- Produksi makanan dan minuman: Titrasi digunakan untuk mengontrol keasaman dan pH produk makanan dan minuman.
Dalam Penelitian
- Analisis lingkungan: Titrasi digunakan untuk menentukan konsentrasi polutan dalam air, tanah, dan udara.
- Kimia analitik: Titrasi adalah teknik dasar dalam kimia analitik untuk menentukan konsentrasi zat yang tidak diketahui.
- Penelitian biokimia: Titrasi digunakan untuk mempelajari sifat dan fungsi enzim, protein, dan molekul biologis lainnya.
Dalam Kehidupan Sehari-hari
- Pengujian kadar air: Titrasi digunakan dalam pengujian kadar air dalam tanah, makanan, dan bahan lainnya.
- Perawatan air: Titrasi digunakan untuk mengontrol pH air di kolam renang, akuarium, dan sistem air minum.
- Pembuatan larutan: Titrasi digunakan untuk menyiapkan larutan dengan konsentrasi yang tepat untuk berbagai keperluan, seperti pembersihan, pengobatan, dan eksperimen ilmiah.
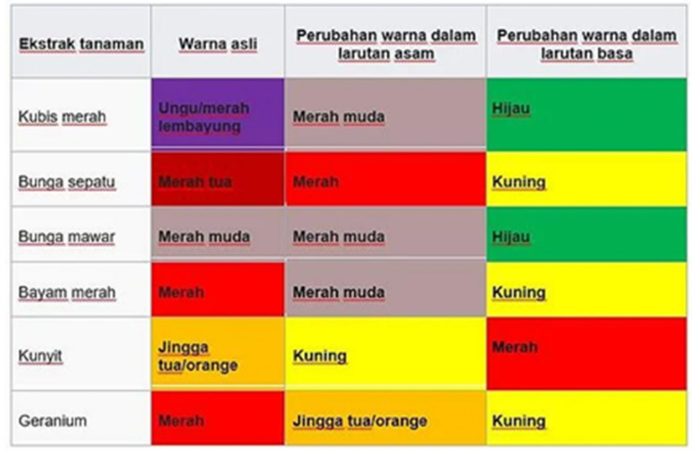
Tabel Indikator Titrasi Asam Basa

Dalam titrasi asam basa, indikator memainkan peran penting dalam mendeteksi titik akhir reaksi. Indikator adalah zat yang berubah warna ketika pH larutan berubah.
Pemilihan indikator yang tepat sangat penting untuk titrasi tertentu. Indikator harus berubah warna pada atau sedekat mungkin dengan titik ekivalen titrasi, yang merupakan titik di mana jumlah mol asam sama dengan jumlah mol basa.
Tabel Indikator Umum
| Indikator | Titik Akhir | Perubahan Warna |
|---|---|---|
| Fenolftalein | 8,2-10,0 | Tidak berwarna → Merah muda |
| Metil jingga | 3,1-4,4 | Merah → Kuning |
| Lakmus | 5,5-8,3 | Merah → Biru |
| Bromotimol biru | 6,0-7,6 | Kuning → Biru |
| Timolftalein | 9,3-10,5 | Tidak berwarna → Biru |
Ilustrasi Titik Ekivalen
Selama titrasi asam basa, perubahan pH larutan dipantau untuk menentukan titik ekivalen. Titik ekivalen adalah titik di mana jumlah ekivalen asam sama dengan jumlah ekivalen basa.
Grafik perubahan pH larutan selama titrasi asam basa menunjukkan kurva berbentuk S.
Pada grafik, titik ekivalen ditandai sebagai titik di mana kurva berubah paling curam. Perubahan pH yang cepat ini terjadi karena penambahan sejumlah kecil asam atau basa yang setara dengan jumlah zat yang dititrasi.
Kesalahan Umum dalam Titrasi Asam Basa
Titrasi asam basa merupakan teknik analitik yang umum digunakan untuk menentukan konsentrasi asam atau basa dalam suatu larutan. Meski prosesnya tampak sederhana, terdapat beberapa kesalahan umum yang dapat terjadi dan memengaruhi akurasi dan presisi hasil titrasi.
Berikut adalah beberapa kesalahan umum yang terjadi dalam titrasi asam basa dan cara menghindarinya:
- Penggunaan Indikator yang Tidak Tepat: Indikator yang dipilih harus berubah warna pada titik ekivalen titrasi. Jika indikator yang digunakan tidak tepat, titik ekivalen dapat terlewatkan atau ditentukan secara tidak akurat.
- Pengukuran Volume yang Tidak Akurat: Buret dan pipet yang digunakan untuk mengukur volume harus dikalibrasi dan digunakan dengan benar. Kesalahan dalam pengukuran volume dapat menyebabkan ketidakakuratan yang signifikan dalam hasil titrasi.
- Pengadukan yang Tidak Cukup: Larutan harus diaduk secara menyeluruh selama titrasi untuk memastikan pencampuran yang merata. Pengadukan yang tidak cukup dapat menyebabkan gradien konsentrasi dan memengaruhi hasil titrasi.
- Titik Akhir yang Tidak Jelas: Titik akhir titrasi harus jelas dan mudah diamati. Jika titik akhir tidak jelas, dapat menyebabkan kesalahan dalam menentukan volume titran yang ditambahkan.
- Kontaminasi Larutan: Larutan yang digunakan dalam titrasi harus bebas dari kontaminan. Kontaminan dapat bereaksi dengan asam atau basa dan memengaruhi hasil titrasi.
Pentingnya Akurasi dan Presisi
Akurasi dan presisi sangat penting dalam titrasi asam basa. Akurasi mengacu pada seberapa dekat hasil titrasi dengan nilai sebenarnya, sedangkan presisi mengacu pada seberapa konsisten hasil titrasi yang diperoleh. Kesalahan dalam titrasi dapat memengaruhi akurasi dan presisi hasil, sehingga penting untuk meminimalkan kesalahan ini sebisa mungkin.
Dengan mengikuti praktik yang baik dan menghindari kesalahan umum, titrasi asam basa dapat memberikan hasil yang akurat dan presisi, menjadikannya teknik yang berharga untuk analisis kimia.
Ringkasan Akhir

Memahami cara kerja titrasi asam basa sangat penting untuk memperoleh hasil yang akurat dan dapat diandalkan. Dengan mengikuti prosedur yang tepat dan menghindari kesalahan umum, teknik ini dapat menjadi alat yang ampuh untuk analisis kimia kuantitatif.
Tanya Jawab (Q&A)
Apa tujuan titrasi asam basa?
Untuk menentukan konsentrasi zat yang tidak diketahui dengan menambahkan larutan standar secara bertahap.
Apa peran indikator dalam titrasi asam basa?
Untuk menunjukkan titik ekivalen dengan mengubah warna.
Apa saja aplikasi titrasi asam basa?
Dalam industri, penelitian, dan kehidupan sehari-hari, seperti dalam pembuatan obat-obatan, analisis lingkungan, dan pengendalian kualitas makanan.
