Dalam reaksi kimia, pereaksi pembatas memainkan peran penting dalam menentukan hasil dan laju reaksi. Memahami konsep pereaksi pembatas sangat penting untuk memprediksi dan mengendalikan reaksi kimia dalam berbagai aplikasi kehidupan sehari-hari. Artikel ini akan memberikan pemahaman yang komprehensif tentang pereaksi pembatas, termasuk definisi, metode identifikasi, dan contoh soal yang akan dibahas secara mendalam.
Pereaksi pembatas adalah reagen dalam reaksi kimia yang habis sepenuhnya selama reaksi, sehingga membatasi jumlah produk yang dihasilkan. Identifikasi pereaksi pembatas sangat penting untuk mengoptimalkan hasil reaksi dan mencegah pemborosan bahan kimia. Dengan memahami konsep ini, peneliti dan ahli kimia dapat mengembangkan dan mengendalikan reaksi kimia secara efisien, membuka jalan bagi kemajuan di berbagai bidang ilmiah dan industri.
Pengertian Pereaksi Pembatas
Pereaksi pembatas adalah reaktan dalam reaksi kimia yang habis dikonsumsi terlebih dahulu, membatasi jumlah produk yang dapat terbentuk.
Dalam reaksi kimia:
aA + bB → cC + dD
Jika a mol A bereaksi dengan b mol B, dan a/b< c/d, maka A adalah pereaksi pembatas.
Contoh Reaksi Kimia
- 2H2 + O2 → 2H2O
- Dalam reaksi ini, jika 4 mol H2 bereaksi dengan 2 mol O2, maka H2 adalah pereaksi pembatas karena a/b (4/2) < c/d (2/2).
Mengidentifikasi Pereaksi Pembatas
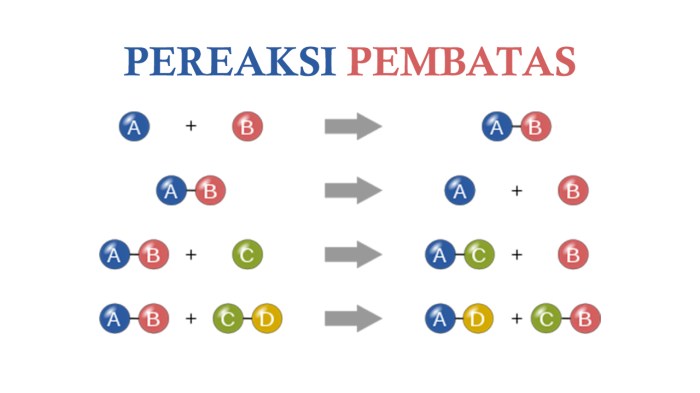
Dalam reaksi kimia, pereaksi pembatas adalah pereaksi yang habis terpakai terlebih dahulu, sehingga membatasi jumlah produk yang dapat dihasilkan. Mengidentifikasi pereaksi pembatas sangat penting untuk memprediksi hasil reaksi dan mengoptimalkan proses kimia.
Langkah-langkah Mengidentifikasi Pereaksi Pembatas
- Tulis persamaan reaksi kimia yang seimbang.
- Ubah semua koefisien reaktan menjadi mol.
- Bandingkan mol masing-masing reaktan dengan rasio koefisiennya dalam persamaan reaksi yang seimbang.
- Reaktan dengan mol terkecil relatif terhadap rasio koefisiennya adalah pereaksi pembatas.
Perbandingan Pereaksi Pembatas dan Pereaksi Berlebih
| Karakteristik | Pereaksi Pembatas | Pereaksi Berlebih |
|---|---|---|
| Tersedia | Habis terpakai | Tersisa |
| Membatasi | Jumlah produk | Tidak membatasi jumlah produk |
| Perhitungan | Mol terkecil relatif terhadap rasio koefisien | Mol lebih besar dari mol pereaksi pembatas |
Menentukan Pereaksi Pembatas Secara Stoikiometri

Menentukan pereaksi pembatas sangat penting dalam reaksi kimia karena menentukan reaktan yang habis terlebih dahulu dan membatasi jumlah produk yang dapat dihasilkan.
Cara Menentukan Pereaksi Pembatas
Untuk menentukan pereaksi pembatas secara stoikiometri, ikuti langkah-langkah berikut:
- Tuliskan persamaan reaksi kimia yang setara.
- Ubah semua koefisien dalam persamaan menjadi mol.
- Bagi jumlah mol setiap reaktan dengan koefisien molnya dalam persamaan.
- Reaksi pembatas adalah reaktan dengan nilai terendah yang diperoleh dari langkah 3.
Contoh Perhitungan Stoikiometri
Sebagai contoh, pertimbangkan reaksi antara metana (CH 4 ) dan oksigen (O 2 ):
CH 4 + 2O 2 → CO 2 + 2H 2 O
Jika kita memiliki 2 mol metana dan 5 mol oksigen, manakah reaktan pembatasnya?
Langkah 1: Ubah koefisien menjadi mol
1 mol CH 4 dan 2 mol O 2
Langkah 2: Bagi jumlah mol dengan koefisien
CH 4 : 2 mol / 1 mol = 2
O 2 : 5 mol / 2 mol = 2,5
Langkah 3: Tentukan reaktan pembatas
CH 4 memiliki nilai terendah (2), sehingga CH 4 adalah reaktan pembatas.
Faktor-Faktor yang Mempengaruhi Pereaksi Pembatas
Dalam reaksi kimia, pereaksi pembatas memainkan peran penting dalam menentukan hasil reaksi. Berbagai faktor dapat mempengaruhi pereaksi pembatas, antara lain:
Stoikiometri Reaksi
Stoikiometri reaksi mengacu pada perbandingan molar reaktan dalam reaksi kimia. Ketika reaktan tidak ditambahkan dalam rasio stoikiometri yang tepat, salah satu reaktan akan habis terlebih dahulu, menjadi pereaksi pembatas.
Konsentrasi Reaktan
Konsentrasi reaktan juga mempengaruhi pereaksi pembatas. Reaktan dengan konsentrasi lebih rendah cenderung menjadi pereaksi pembatas karena akan habis lebih cepat dibandingkan reaktan dengan konsentrasi lebih tinggi.
Laju Reaksi
Laju reaksi dapat mempengaruhi pereaksi pembatas. Reaksi yang melibatkan reaktan dengan laju reaksi lebih tinggi akan cenderung mengkonsumsi reaktan tersebut lebih cepat, menjadikannya pereaksi pembatas.
Katalis
Katalis adalah zat yang meningkatkan laju reaksi tanpa dikonsumsi. Katalis dapat mempengaruhi pereaksi pembatas dengan mengubah laju reaksi reaktan yang berbeda, sehingga mengubah pereaksi yang menjadi pembatas.
Temperatur
Temperatur dapat mempengaruhi laju reaksi dan, oleh karena itu, pereaksi pembatas. Peningkatan suhu umumnya meningkatkan laju reaksi, yang dapat menyebabkan pergeseran pereaksi pembatas.
Contoh Soal dan Pembahasan Pereaksi Pembatas

Pereaksi pembatas merupakan reaktan yang habis terlebih dahulu dalam reaksi kimia. Untuk menentukan pereaksi pembatas, kita perlu membandingkan rasio mol reaktan dengan koefisien stoikiometrinya.
Contoh Soal 1
Reaktan A dan B bereaksi menurut persamaan reaksi:
“`
A + 3B → C
“`
Jika 1 mol A dan 2 mol B direaksikan, tentukan pereaksi pembatasnya.
Pembahasan:
- Hitung mol reaktan yang tersedia:
- Mol A: 1 mol
- Mol B: 2 mol
- Bandingkan rasio mol reaktan dengan koefisien stoikiometri:
- Rasio mol A: 1 mol / 2 = 0,5
- Rasio mol B: 2 mol / 3 = 0,67
- Reaktan dengan rasio mol terkecil adalah pereaksi pembatas.
- Dalam kasus ini, rasio mol A lebih kecil dari rasio mol B, sehingga A adalah pereaksi pembatas.
Aplikasi Pereaksi Pembatas dalam Kehidupan Sehari-hari
Konsep pereaksi pembatas berperan penting dalam berbagai aspek kehidupan sehari-hari, mulai dari industri hingga penelitian.
Contoh Penggunaan dalam Industri
- Produksi Kimia: Pereaksi pembatas digunakan untuk mengoptimalkan hasil reaksi kimia dan meminimalkan limbah, seperti dalam produksi asam sulfat dan pupuk.
- Pengolahan Limbah: Menentukan pereaksi pembatas sangat penting dalam proses pengolahan air limbah untuk memastikan penghilangan polutan secara efisien.
- Industri Makanan: Pereaksi pembatas digunakan dalam produksi makanan untuk mengontrol rasa, tekstur, dan nilai gizi, seperti dalam pembuatan roti dan minuman.
Contoh Penggunaan dalam Penelitian
- Pengembangan Obat: Pereaksi pembatas membantu mengidentifikasi dan mengoptimalkan dosis obat untuk memaksimalkan efektivitas dan meminimalkan efek samping.
- Penelitian Medis: Konsep pereaksi pembatas digunakan dalam studi enzimatik dan metabolisme untuk memahami mekanisme penyakit dan mengembangkan pengobatan.
- Penelitian Lingkungan: Pereaksi pembatas berperan dalam studi kualitas air, tanah, dan udara untuk mengidentifikasi sumber polusi dan mengembangkan strategi mitigasi.
Akhir Kata
Pemahaman tentang pereaksi pembatas sangat penting dalam berbagai bidang, mulai dari kimia industri hingga penelitian biomedis. Dengan mengidentifikasi dan menentukan pereaksi pembatas, para ilmuwan dapat mengoptimalkan reaksi kimia, meningkatkan efisiensi, dan meminimalkan pemborosan. Contoh soal yang dibahas dalam artikel ini memberikan landasan yang kuat untuk memahami konsep ini, memungkinkan pembaca untuk menerapkannya dalam situasi praktis dan memajukan pengetahuan mereka tentang kimia.
Ringkasan FAQ
Apa saja faktor yang dapat mempengaruhi pereaksi pembatas?
Faktor-faktor yang dapat mempengaruhi pereaksi pembatas meliputi konsentrasi awal reagen, suhu reaksi, tekanan (untuk reaksi gas), dan katalis.
Bagaimana cara menentukan pereaksi pembatas menggunakan stoikiometri?
Untuk menentukan pereaksi pembatas menggunakan stoikiometri, kita perlu membandingkan mol reagen dengan koefisien stoikiometri dalam persamaan reaksi yang setara.
Apa saja aplikasi pereaksi pembatas dalam kehidupan sehari-hari?
Aplikasi pereaksi pembatas dalam kehidupan sehari-hari meliputi produksi bahan kimia, sintesis obat, dan pengendalian polusi.
