Dalam dunia fisika dan kimia, bilangan kuantum memegang peran krusial dalam menguraikan perilaku elektron dan memahami sifat materi pada tingkat atom. Bilangan-bilangan ini menyediakan kerangka kerja untuk mendeskripsikan keadaan elektron dalam suatu atom, membentuk dasar untuk pemahaman tentang struktur atom dan sifat kimia.
Konsep bilangan kuantum pertama kali diperkenalkan pada awal abad ke-20, merevolusi pemahaman kita tentang mekanika kuantum dan sifat partikel subatomik. Empat jenis bilangan kuantum, yaitu bilangan kuantum utama (n), azimut (l), magnetik (ml), dan spin (ms), masing-masing memberikan informasi unik tentang keadaan elektron dalam atom.
Konsep Bilangan Kuantum
Bilangan kuantum adalah seperangkat angka yang menggambarkan sifat-sifat elektron dalam atom. Mereka memainkan peran penting dalam kimia, karena membantu kita memahami struktur atom, sifat-sifat kimia, dan reaksi kimia.
Ada empat jenis bilangan kuantum:
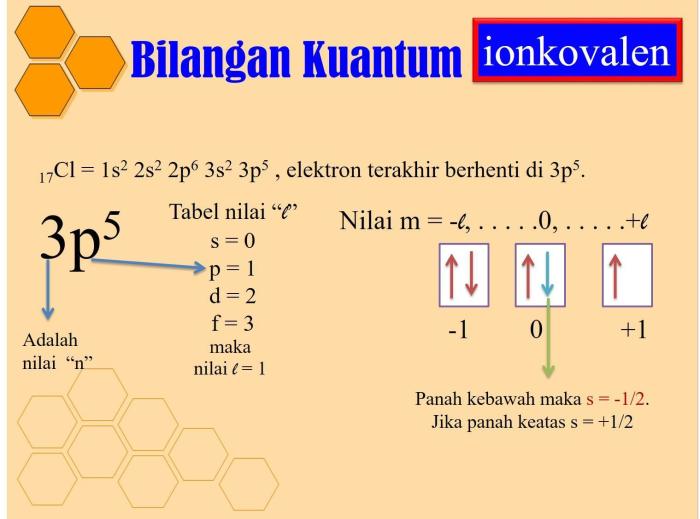
Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) menggambarkan tingkat energi elektron. Semakin tinggi nilai n, semakin tinggi tingkat energinya.
Bilangan Kuantum Azimut (l)
Bilangan kuantum azimut (l) menggambarkan bentuk orbital elektron. Ini dapat memiliki nilai dari 0 hingga n-1.
Bilangan Kuantum Magnetik (ml)
Bilangan kuantum magnetik (ml) menggambarkan orientasi orbital elektron dalam ruang. Ini dapat memiliki nilai dari -l hingga l.
Bilangan Kuantum Spin (ms)
Bilangan kuantum spin (ms) menggambarkan arah putaran elektron. Ini dapat memiliki nilai +1/2 atau -1/2.
Bilangan Kuantum Utama (n)

Bilangan kuantum utama (n) menggambarkan tingkat energi elektron dalam sebuah atom. Semakin tinggi nilai n, semakin tinggi tingkat energi elektron.
Nilai yang mungkin untuk n adalah bilangan bulat positif (n = 1, 2, 3, …). Setiap nilai n mewakili sebuah kulit elektron, dengan kulit pertama (n = 1) berada paling dekat dengan inti dan kulit berikutnya (n = 2, 3, …) semakin jauh dari inti.
Nilai yang Mungkin untuk n
- n = 1: Kulit K
- n = 2: Kulit L
- n = 3: Kulit M
- n = 4: Kulit N
- dst.
Bilangan Kuantum Spin (ms)

Bilangan kuantum spin (ms) menggambarkan sifat intrinsik elektron yang terkait dengan putarannya pada porosnya. Elektron memiliki dua nilai yang mungkin untuk ms, yaitu +1/2 dan1/2. Nilai-nilai ini merepresentasikan dua arah putaran yang berlawanan, yang sering disebut sebagai “putaran atas” dan “putaran bawah”.
Implikasi Prinsip Pengecualian Pauli
Prinsip pengecualian Pauli menyatakan bahwa tidak ada dua elektron dalam suatu atom yang dapat memiliki keempat bilangan kuantum yang sama. Ini berarti bahwa dalam sebuah orbital, hanya dua elektron yang dapat dipasangkan, dan mereka harus memiliki nilai ms yang berlawanan.
Pembatasan ini memainkan peran penting dalam menentukan sifat kimia dan struktur atom.
Konfigurasi Elektron

Konfigurasi elektron adalah distribusi elektron dalam berbagai orbital atom. Bilangan kuantum memainkan peran penting dalam memprediksi konfigurasi elektron suatu atom.Bilangan kuantum utama (n) menentukan tingkat energi orbital, sedangkan bilangan kuantum azimut (l) menentukan bentuk orbital. Bilangan kuantum magnetik (ml) menentukan orientasi orbital dalam ruang, dan bilangan kuantum spin (ms) menentukan arah putaran elektron.
Langkah-Langkah Menentukan Konfigurasi Elektron
Untuk menentukan konfigurasi elektron suatu atom, ikuti langkah-langkah berikut:
- Tuliskan simbol unsur kimia.
- Tentukan jumlah elektron dalam atom.
- Isi orbital dengan elektron, dimulai dari orbital dengan energi terendah.
- Setiap orbital dapat menampung maksimal dua elektron dengan spin berlawanan.
- Lanjutkan mengisi orbital hingga semua elektron terdistribusi.
Akhir Kata
Dengan menguasai konsep bilangan kuantum, siswa kelas 10 dapat memperoleh pemahaman yang mendalam tentang struktur atom, perilaku elektron, dan sifat-sifat kimia unsur. Bilangan kuantum tidak hanya merupakan alat yang ampuh untuk memecahkan soal-soal kimia, tetapi juga memberikan wawasan tentang prinsip-prinsip dasar yang mengatur dunia materi pada tingkat atom.
Sudut Pertanyaan Umum (FAQ)
Apa itu bilangan kuantum?
Bilangan kuantum adalah bilangan yang digunakan untuk mendeskripsikan keadaan elektron dalam suatu atom, seperti tingkat energinya, bentuk orbitalnya, dan orientasinya dalam ruang.
Berapa banyak jenis bilangan kuantum?
Ada empat jenis bilangan kuantum: bilangan kuantum utama (n), azimut (l), magnetik (ml), dan spin (ms).
Apa fungsi bilangan kuantum utama?
Bilangan kuantum utama menentukan tingkat energi elektron dalam atom.
Bagaimana bilangan kuantum azimut memengaruhi bentuk orbital?
Bilangan kuantum azimut menentukan bentuk orbital elektron, seperti bentuk s, p, d, atau f.
Apa yang dijelaskan oleh bilangan kuantum spin?
Bilangan kuantum spin menggambarkan sifat intrinsik elektron, yaitu arah putarannya.
