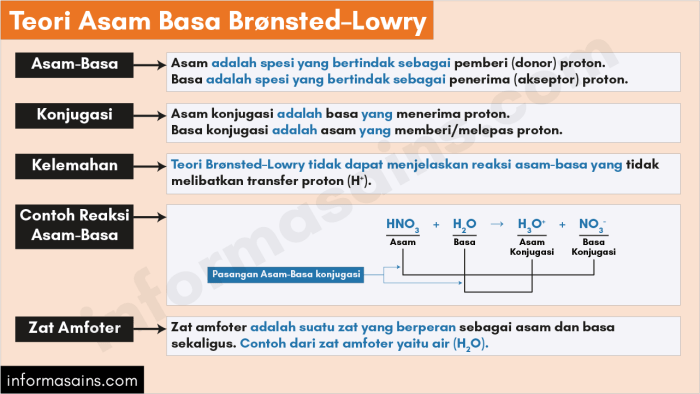
Teori asam-basa Bronsted-Lowry merupakan salah satu konsep mendasar dalam kimia yang menjelaskan interaksi asam dan basa melalui transfer proton. Teori ini memberikan pemahaman komprehensif tentang reaksi kimia yang melibatkan perpindahan ion hidrogen, memungkinkan kita untuk mengidentifikasi dan memprediksi sifat asam dan basa dalam berbagai sistem.
Teori Asam-Basa Bronsted-Lowry
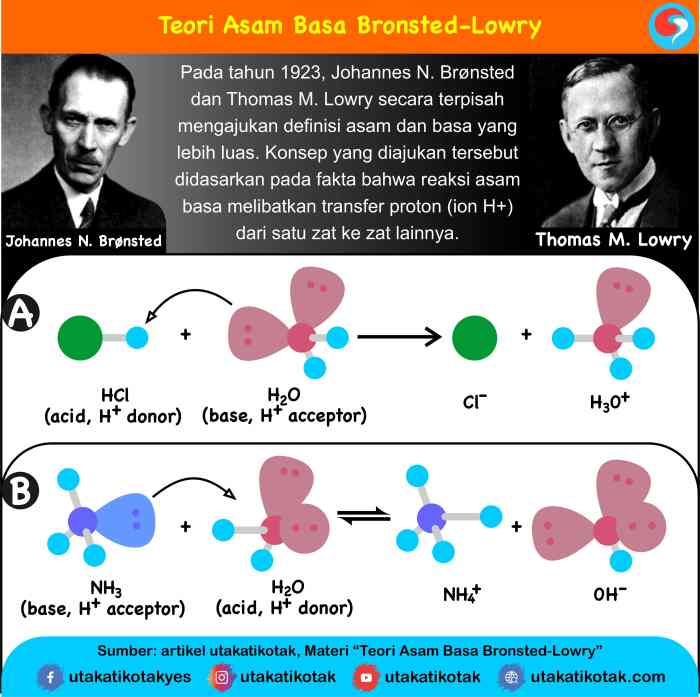
Teori Asam-Basa Bronsted-Lowry adalah teori yang mendefinisikan asam dan basa berdasarkan kemampuannya untuk menerima atau melepaskan ion hidrogen (H+).
Menurut teori ini, asam adalah zat yang dapat melepaskan ion H+, sedangkan basa adalah zat yang dapat menerima ion H+.
Reaksi Asam-Basa
Ketika asam dan basa bereaksi, terjadi transfer ion H+ dari asam ke basa. Reaksi ini menghasilkan garam dan air.
Contoh reaksi asam-basa yang sesuai dengan teori Bronsted-Lowry adalah:
HCl + NaOH → NaCl + H2O
Dalam reaksi ini, HCl bertindak sebagai asam karena melepaskan ion H+, sedangkan NaOH bertindak sebagai basa karena menerima ion H+.
Identifikasi Asam dan Basa
Teori asam-basa Brønsted-Lowry mendefinisikan asam dan basa berdasarkan kemampuannya untuk mentransfer proton (ion hidrogen, H + ). Menurut teori ini, asam adalah zat yang dapat menyumbangkan proton, sedangkan basa adalah zat yang dapat menerima proton.
Petunjuk Identifikasi Asam dan Basa
- Asam: Zat yang dapat melepaskan proton dalam reaksi kimia.
- Basa: Zat yang dapat menerima proton dalam reaksi kimia.
Jenis-jenis Asam dan Basa
| Jenis Asam | Contoh |
|---|---|
| Asam Kuat | HCl, H2SO4, HNO3 |
| Asam Lemah | CH3COOH, HCOOH, H2CO3 |
| Jenis Basa | Contoh |
|---|---|
| Basa Kuat | NaOH, KOH, Ca(OH)2 |
| Basa Lemah | NH3, CH3NH2, NaHCO3 |
Reaksi Asam-Basa Bronsted-Lowry
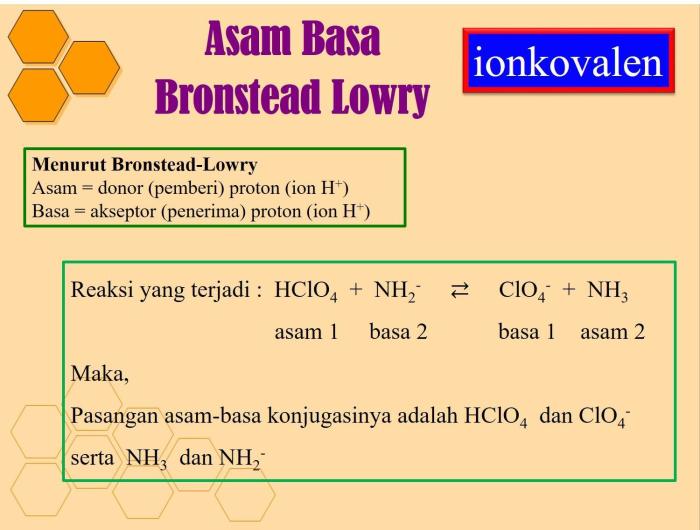
Teori Bronsted-Lowry mendefinisikan asam sebagai pemberi proton (H+) dan basa sebagai penerima proton. Dalam reaksi asam-basa, asam bereaksi dengan basa untuk membentuk basa konjugasinya dan asam konjugasinya.
Proses Reaksi
Reaksi asam-basa Bronsted-Lowry terjadi dalam dua langkah:
- Transfer proton dari asam ke basa
- Pembentukan basa konjugasi dan asam konjugasi
Langkah Menyeimbangkan Reaksi Asam-Basa
Untuk menyeimbangkan reaksi asam-basa, ikuti langkah-langkah berikut:
- Tulis persamaan reaksi awal.
- Tambahkan air (H2O) ke kedua sisi persamaan untuk memberikan proton atau hidroksida yang diperlukan.
- Seimbangkan atom hidrogen dan oksigen.
- Seimbangkan muatan dengan menambahkan ion hidrogen (H+) atau hidroksida (OH-) yang sesuai.
Contoh Reaksi Asam-Basa

Teori asam-basa Bronsted-Lowry mendefinisikan asam sebagai spesies yang dapat menyumbangkan proton (H+), sedangkan basa sebagai spesies yang dapat menerima proton.
Reaksi Asam-Basa Bronsted-Lowry
| Reaksi | Asam | Basa |
|---|---|---|
| HCl + NaOH → NaCl + H2O | HCl | NaOH |
| CH3COOH + NH3 → CH3COONH4 | CH3COOH | NH3 |
| H2SO4 + 2KOH → K2SO4 + 2H2O | H2SO4 | KOH |
| HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O | HNO3 | Ba(OH)2 |
Dalam setiap reaksi, asam menyumbangkan proton yang diterima oleh basa. Hasil reaksi adalah pembentukan garam dan air.
Aplikasi Teori Asam-Basa Bronsted-Lowry

Teori asam-basa Bronsted-Lowry memiliki aplikasi luas dalam berbagai bidang, termasuk kehidupan sehari-hari, kedokteran, industri, dan lingkungan.
Kehidupan Sehari-hari
- Keasaman Jus Lemon: Jus lemon mengandung asam sitrat, yang merupakan asam lemah yang bereaksi dengan air untuk menghasilkan ion H+, memberikan rasa asam.
- Aktivitas Pembersih: Banyak pembersih rumah tangga mengandung asam atau basa untuk menghilangkan kotoran dan noda.
Kedokteran
- Pencernaan: Asam lambung (asam klorida) membantu memecah makanan dengan memberikan lingkungan asam.
- Pengobatan Maag: Antasida menetralkan asam lambung berlebih, meredakan gejala maag.
- Anestesi: Beberapa anestesi bekerja dengan mengubah keseimbangan asam-basa tubuh.
Industri
- Produksi Pupuk: Asam sulfat digunakan dalam produksi pupuk untuk memberikan unsur sulfur bagi tanaman.
- Pemurnian Minyak: Asam dan basa digunakan untuk menghilangkan kotoran dari minyak mentah.
- Pembuatan Kertas: Asam klorida digunakan untuk melarutkan lignin dari kayu, menghasilkan pulp kertas.
Lingkungan
- Hujan Asam: Emisi gas sulfur dioksida dan nitrogen oksida dari aktivitas industri bereaksi dengan air di atmosfer untuk membentuk hujan asam.
- Pengasaman Laut: Peningkatan kadar karbon dioksida di atmosfer bereaksi dengan air laut, menurunkan pH-nya.
- Pengolahan Limbah: Asam dan basa digunakan untuk menetralkan limbah industri dan rumah tangga.
Simpulan Akhir
Pemahaman tentang contoh reaksi asam-basa Bronsted-Lowry sangat penting dalam berbagai bidang, mulai dari kedokteran hingga industri. Teori ini membantu kita memahami mekanisme aksi obat-obatan, reaksi dalam proses industri, dan keseimbangan asam-basa dalam lingkungan. Dengan terus mengeksplorasi dan memahami reaksi-reaksi ini, kita dapat mengembangkan solusi inovatif untuk masalah dunia nyata dan memajukan pengetahuan kita tentang kimia dan interaksinya dengan kehidupan sehari-hari.
Ringkasan FAQ
Apa perbedaan antara asam dan basa menurut teori Bronsted-Lowry?
Asam adalah zat yang dapat mendonorkan proton (H+), sedangkan basa adalah zat yang dapat menerima proton.
Bagaimana cara mengidentifikasi asam dan basa dalam reaksi kimia?
Dalam reaksi asam-basa Bronsted-Lowry, asam adalah zat yang mengandung ion H+ yang dapat ditransfer, sedangkan basa adalah zat yang mengandung pasangan elektron bebas yang dapat menerima ion H+.
Sebutkan contoh reaksi asam-basa Bronsted-Lowry.
Reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH) adalah contoh reaksi asam-basa Bronsted-Lowry: HCl + NaOH → NaCl + H2O.