Dalam kimia, pH memainkan peran penting dalam menentukan sifat dan reaktivitas suatu larutan. Dalam larutan suasana asam, pH rendah menyebabkan kondisi asam yang mempengaruhi reaksi kimia, kelarutan, dan aplikasi industri.
Paragraf ini akan membahas dampak pH pada reaksi kimia, kelarutan zat, aplikasi industri larutan asam, prosedur penanganan yang aman, dan dampak lingkungannya, dengan fokus khusus pada larutan suasana asam 0,56.
Reaksi Kimia dalam Larutan Asam
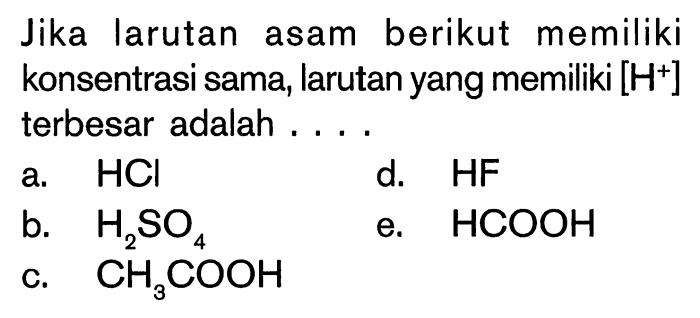
Larutan asam memainkan peran penting dalam berbagai reaksi kimia. Memahami sifat dan perilaku asam sangat penting untuk memprediksi dan mengontrol reaksi-reaksi ini.
Konsep pH dan Reaksi Kimia
pH adalah ukuran keasaman atau kebasaan suatu larutan. Skala pH berkisar dari 0 hingga 14, dengan 7 sebagai netral. Larutan dengan pH di bawah 7 bersifat asam, sedangkan yang di atas 7 bersifat basa.
pH mempengaruhi reaksi kimia dengan mengubah konsentrasi ion hidrogen (H+) dalam larutan. Ion H+ dapat bereaksi dengan zat lain, mengubah laju dan arah reaksi.
Sifat Asam dan Laju Reaksi
Sifat asam, seperti kekuatan dan konsentrasi, dapat mempengaruhi laju reaksi. Asam kuat cenderung berdisosiasi sepenuhnya dalam air, menghasilkan konsentrasi ion H+ yang tinggi. Hal ini dapat mempercepat reaksi yang bergantung pada ion H+.
Sebaliknya, asam lemah berdisosiasi sebagian dalam air, menghasilkan konsentrasi ion H+ yang lebih rendah. Hal ini dapat memperlambat reaksi yang bergantung pada ion H+.
Contoh Reaksi Kimia dalam Larutan Asam 0,56
Dalam larutan asam dengan pH 0,56, terjadi beberapa reaksi kimia:
- Netralisasi: Asam bereaksi dengan basa untuk membentuk garam dan air. Misalnya, asam klorida (HCl) bereaksi dengan natrium hidroksida (NaOH) untuk membentuk natrium klorida (NaCl) dan air.
- Disolusi logam: Asam dapat melarutkan logam tertentu, membentuk garam dan gas hidrogen. Misalnya, asam klorida bereaksi dengan besi (Fe) untuk membentuk besi(II) klorida (FeCl2) dan gas hidrogen.
- Hidrolisis: Asam dapat bereaksi dengan air untuk membentuk ion hidrogen dan anion. Misalnya, asam asetat (CH3COOH) bereaksi dengan air untuk membentuk ion hidrogen (H+) dan ion asetat (CH3COO-).
Pengaruh pH pada Kelarutan

Kelarutan zat dalam larutan dipengaruhi oleh pH larutan. pH mengukur keasaman atau kebasaan larutan pada skala 0 sampai 14, dengan 0 sebagai yang paling asam dan 14 sebagai yang paling basa.
Secara umum, kelarutan zat meningkat seiring dengan peningkatan pH. Hal ini karena ion hidrogen (H+) dalam larutan asam dapat bersaing dengan kation lain untuk berikatan dengan anion, sehingga mengurangi kelarutan zat.
Pengaruh pH pada Kelarutan Zat Tertentu
| Zat | Kelarutan pada pH 0,56 (g/100 mL) |
|---|---|
| Natrium klorida (NaCl) | 36 |
| Kalsium karbonat (CaCO3) | 0,0002 |
| Besi(II) hidroksida (Fe(OH)2) | 0,0001 |
Faktor Lain yang Mempengaruhi Kelarutan
Selain pH, terdapat faktor lain yang dapat mempengaruhi kelarutan zat, antara lain:
- Suhu: Kelarutan biasanya meningkat seiring dengan peningkatan suhu.
- Ukuran partikel: Semakin kecil ukuran partikel, semakin besar luas permukaan yang tersedia untuk berinteraksi dengan pelarut, sehingga meningkatkan kelarutan.
- Sifat pelarut: Sifat pelarut, seperti polaritas dan viskositas, dapat mempengaruhi kelarutan zat terlarut.
Prosedur Penanganan Larutan Asam

Menangani larutan asam membutuhkan prosedur yang aman dan tepat untuk mencegah kecelakaan dan memastikan keselamatan.
Untuk memastikan penanganan larutan asam yang aman, ikuti langkah-langkah berikut:
Langkah-Langkah Penanganan Larutan Asam
- Kenakan alat pelindung diri (APD) yang sesuai, termasuk sarung tangan tahan bahan kimia, jas lab, kacamata pengaman, dan sepatu tertutup.
- Selalu encerkan asam dengan menambahkan asam ke dalam air, bukan sebaliknya.
- Gunakan peralatan gelas yang sesuai dan pastikan dalam kondisi baik.
- Hindari kontak langsung dengan larutan asam.
- Berhati-hatilah saat memanaskan larutan asam, karena dapat menyebabkan percikan atau letupan.
- Jangan pernah menuang larutan asam ke saluran pembuangan.
Pembuangan Larutan Asam
Larutan asam harus dibuang dengan benar untuk menghindari kerusakan lingkungan dan kesehatan manusia.
Metode pembuangan yang disarankan meliputi:
- Netralisasi: Menetralkan larutan asam dengan basa sebelum dibuang.
- Penetralan dan pengendapan: Menambahkan basa untuk menetralkan asam dan kemudian menambahkan bahan kimia pengendapan untuk membentuk endapan yang dapat dibuang.
- Pengolahan air limbah: Beberapa fasilitas pengolahan air limbah dapat menerima larutan asam untuk diolah dan dibuang dengan benar.
Dampak Lingkungan dari Larutan Asam
Larutan asam dapat memberikan dampak negatif yang signifikan terhadap lingkungan, mempengaruhi kualitas air, udara, dan tanah.
Pengaruh larutan asam pada lingkungan terutama disebabkan oleh sifat korosifnya, yang dapat merusak struktur dan ekosistem.
Polusi Air
Larutan asam dapat mencemari sumber air seperti sungai, danau, dan lautan, menurunkan pH air dan mengganggu keseimbangan ekosistem akuatik.
- Asam dapat melarutkan logam berat dari sedimen, membuatnya tersedia secara biologis dan membahayakan organisme air.
- pH asam dapat menghambat pertumbuhan dan reproduksi organisme akuatik, seperti ikan dan invertebrata.
Polusi Udara
Larutan asam dapat melepaskan gas asam seperti sulfur dioksida (SO2) dan nitrogen oksida (NOx) ke atmosfer.
- Gas-gas ini dapat menyebabkan hujan asam, yang dapat merusak hutan, danau, dan bangunan.
- Partikel asam juga dapat menyebabkan masalah pernapasan pada manusia dan hewan.
Upaya Pengurangan Dampak
Beberapa upaya dapat dilakukan untuk mengurangi dampak lingkungan dari larutan asam:
- Mengurangi emisi gas asam dari industri dan kendaraan.
- Menggunakan bahan bakar rendah sulfur dan teknologi pengendalian emisi.
- Menerapkan praktik terbaik dalam penanganan dan pembuangan larutan asam.
Penutup

Memahami sifat dan pengaruh larutan asam sangat penting untuk aplikasi industri, penanganan yang aman, dan mitigasi dampak lingkungan. Dengan menyeimbangkan penggunaan larutan asam secara bijaksana dengan tindakan pencegahan yang tepat, kita dapat memanfaatkan manfaatnya sekaligus meminimalkan potensi risikonya.
Jawaban untuk Pertanyaan Umum
Apa yang dimaksud dengan pH?
pH adalah ukuran tingkat keasaman atau kebasaan suatu larutan, dengan nilai 0 menunjukkan keasaman tertinggi dan 14 menunjukkan kebasaan tertinggi.
Mengapa larutan asam 0,56 dianggap asam?
Larutan dengan pH kurang dari 7 dianggap asam. pH 0,56 menunjukkan tingkat keasaman yang signifikan, menjadikannya larutan asam.
Bagaimana pH mempengaruhi kelarutan zat?
pH dapat mempengaruhi kelarutan zat dengan mengubah muatan ioniknya, yang berdampak pada interaksi antara zat terlarut dan pelarut.
Apa saja aplikasi industri larutan asam?
Larutan asam digunakan dalam berbagai industri, seperti industri makanan, farmasi, dan pengolahan air, untuk tujuan seperti pengawetan, sintesis kimia, dan pembersihan.
