Asam dan basa, sebagai pilar kimia, memiliki peran penting dalam berbagai aspek kehidupan. Dari proses biologis hingga aplikasi industri, pemahaman tentang sifat dan perilaku asam kuat, asam lemah, basa kuat, dan basa lemah sangat penting. Artikel ini menyoroti karakteristik unik dari masing-masing kategori ini, mengeksplorasi disosiasinya dalam larutan, dan membahas implikasinya yang luas dalam kehidupan sehari-hari dan lingkungan.
Definisi asam dan basa telah berevolusi seiring perkembangan kimia. Saat ini, teori asam-basa Bronsted-Lowry mendominasi, mendefinisikan asam sebagai pemberi proton dan basa sebagai penerima proton. Berdasarkan kekuatan disosiasinya, asam dan basa diklasifikasikan menjadi kuat atau lemah, yang mengarah pada perbedaan sifat kimia yang signifikan.
Definisi dan Sifat Asam Kuat dan Asam Lemah
Dalam kimia, asam diklasifikasikan menjadi asam kuat dan asam lemah berdasarkan tingkat ionisasinya dalam larutan.
Definisi Asam Kuat
Asam kuat adalah asam yang terionisasi sempurna dalam larutan, artinya semua molekul asam berdisosiasi menjadi ion-ionnya.
Definisi Asam Lemah
Asam lemah adalah asam yang terionisasi sebagian dalam larutan, artinya hanya sebagian kecil molekul asam yang berdisosiasi menjadi ion-ionnya.
Sifat Kimia Asam Kuat dan Asam Lemah
- Konduktivitas Listrik: Asam kuat memiliki konduktivitas listrik yang tinggi karena semua molekulnya terionisasi dan menghasilkan banyak ion.
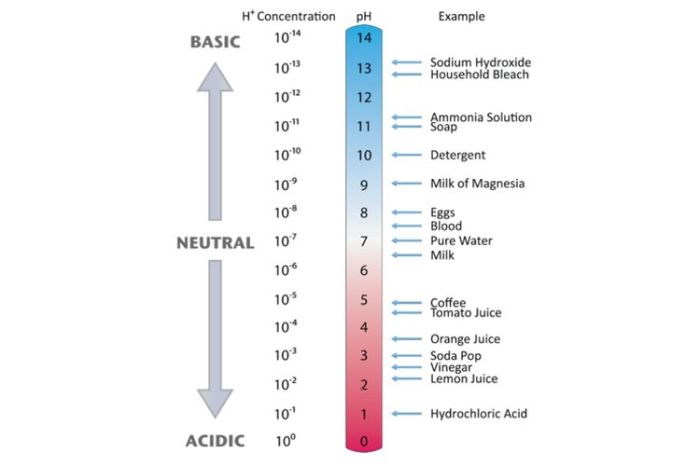
- pH Larutan: Asam kuat menghasilkan larutan dengan pH sangat rendah karena konsentrasi ion H+ yang tinggi.
- Reaksi dengan Basa: Asam kuat bereaksi dengan basa kuat menghasilkan garam dan air melalui reaksi netralisasi.
- Reaksi dengan Logam: Asam kuat dapat bereaksi dengan logam tertentu menghasilkan gas hidrogen.
Sifat Asam Lemah
- Konduktivitas Listrik: Asam lemah memiliki konduktivitas listrik yang rendah karena hanya sebagian kecil molekulnya yang terionisasi.
- pH Larutan: Asam lemah menghasilkan larutan dengan pH lebih tinggi dibandingkan asam kuat karena konsentrasi ion H+ yang lebih rendah.
- Reaksi dengan Basa: Asam lemah bereaksi dengan basa kuat menghasilkan garam dan air, tetapi reaksinya lebih lambat dibandingkan asam kuat.
- Reaksi dengan Logam: Asam lemah biasanya tidak bereaksi dengan logam.
Definisi dan Sifat Basa Kuat dan Basa Lemah
Dalam kimia, basa didefinisikan sebagai zat yang melepaskan ion hidroksida (OH-) ketika dilarutkan dalam air. Basa dapat diklasifikasikan menjadi dua jenis utama: basa kuat dan basa lemah.
Definisi Basa Kuat
Basa kuat adalah basa yang terdisosiasi sempurna dalam air, melepaskan semua ion hidroksida yang dimilikinya. Ini menghasilkan larutan dengan konsentrasi ion hidroksida yang tinggi dan pH tinggi.
Sifat Basa Kuat
- Terdisosiasi sempurna dalam air
- Memiliki pH tinggi (>7)
- Kaustik dan dapat menyebabkan luka bakar pada kulit
- Menghasilkan panas saat dilarutkan dalam air
- Bereaksi dengan asam untuk membentuk garam dan air
Definisi Basa Lemah
Basa lemah adalah basa yang terdisosiasi sebagian dalam air, melepaskan sebagian ion hidroksida yang dimilikinya. Ini menghasilkan larutan dengan konsentrasi ion hidroksida yang lebih rendah dan pH yang lebih rendah dari basa kuat.
Sifat Basa Lemah
- Terdisosiasi sebagian dalam air
- Memiliki pH kurang dari 7
- Tidak kaustik dan tidak menyebabkan luka bakar pada kulit
- Menghasilkan panas yang lebih sedikit saat dilarutkan dalam air
- Bereaksi dengan asam untuk membentuk garam dan air, tetapi kesetimbangan bergeser ke arah reaktan
Perilaku Asam dan Basa dalam Larutan

Asam dan basa adalah senyawa kimia yang memainkan peran penting dalam berbagai reaksi kimia. Ketika dilarutkan dalam air, asam dan basa mengalami proses disosiasi, yang menghasilkan ion-ion yang bertanggung jawab atas sifat asam atau basa dari larutan.
Disosiasi Asam Kuat dan Asam Lemah dalam Air
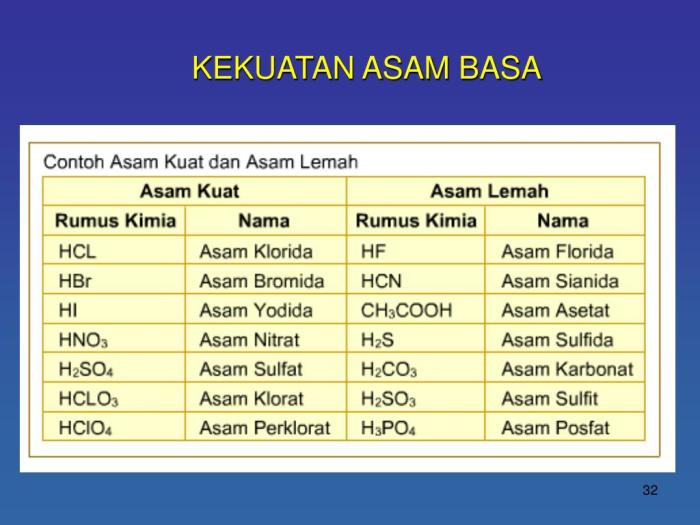
Asam kuat terdisosiasi sempurna dalam air, menghasilkan konsentrasi ion hidrogen (H+) yang tinggi. Contoh asam kuat antara lain asam klorida (HCl) dan asam sulfat (H2SO4). Persamaan disosiasi untuk asam kuat adalah sebagai berikut:
HA + H2O → H3O+ + A-
Sebaliknya, asam lemah hanya terdisosiasi sebagian dalam air, menghasilkan konsentrasi ion hidrogen yang lebih rendah. Contoh asam lemah antara lain asam asetat (CH3COOH) dan asam karbonat (H2CO3). Persamaan disosiasi untuk asam lemah adalah sebagai berikut:
HA + H2O ⇌ H3O+ + A-
Disosiasi Basa Kuat dan Basa Lemah dalam Air
Basa kuat terdisosiasi sempurna dalam air, menghasilkan konsentrasi ion hidroksida (OH-) yang tinggi. Contoh basa kuat antara lain natrium hidroksida (NaOH) dan kalium hidroksida (KOH). Persamaan disosiasi untuk basa kuat adalah sebagai berikut:
MOH → M+ + OH-
Sebaliknya, basa lemah hanya terdisosiasi sebagian dalam air, menghasilkan konsentrasi ion hidroksida yang lebih rendah. Contoh basa lemah antara lain amonia (NH3) dan natrium bikarbonat (NaHCO3). Persamaan disosiasi untuk basa lemah adalah sebagai berikut:
MOH ⇌ M+ + OH-
Tabel Derajat Disosiasi Asam dan Basa
| Jenis | Contoh | Persamaan Disosiasi | Derajat Disosiasi |
|---|---|---|---|
| Asam Kuat | HCl | HA + H2O → H3O+ + A- | 100% |
| Asam Lemah | CH3COOH | HA + H2O ⇌ H3O+ + A- | <100% |
| Basa Kuat | NaOH | MOH → M+ + OH- | 100% |
| Basa Lemah | NH3 | MOH ⇌ M+ + OH- | <100% |
Pengaruh Konsentrasi pada Disosiasi
Konsentrasi suatu larutan mempengaruhi derajat disosiasi asam dan basa. Semakin tinggi konsentrasi, semakin rendah derajat disosiasi. Hal ini disebabkan karena ion-ion yang dihasilkan dari disosiasi akan saling menekan untuk kembali bersatu.
Percobaan untuk Menunjukkan Efek Konsentrasi pada Disosiasi
- Siapkan larutan asam kuat (misalnya HCl) dengan konsentrasi yang berbeda-beda.
- Ukur pH setiap larutan.
- Plot grafik hubungan antara konsentrasi dan pH.
Grafik yang dihasilkan akan menunjukkan bahwa pH meningkat (derajat disosiasi menurun) seiring dengan peningkatan konsentrasi asam.
Aplikasi Asam dan Basa dalam Kehidupan Sehari-hari

Asam dan basa merupakan senyawa kimia yang sangat penting dalam kehidupan sehari-hari, memiliki beragam aplikasi di berbagai bidang, mulai dari industri hingga rumah tangga.
Contoh Penggunaan Asam Kuat dan Asam Lemah
- Asam sulfat (H2SO4): Digunakan dalam produksi baterai, pupuk, dan bahan kimia lainnya.
- Asam klorida (HCl): Digunakan dalam pembersih rumah tangga, produksi logam, dan pengolahan makanan.
- Asam sitrat: Digunakan sebagai pengawet makanan, penyedap rasa, dan pembersih.
Aplikasi Basa Kuat dan Basa Lemah
- Natrium hidroksida (NaOH): Digunakan dalam produksi sabun, kertas, dan rayon.
- Kalsium hidroksida (Ca(OH)2): Digunakan dalam konstruksi, pengolahan air, dan produksi semen.
- Amonia (NH3): Digunakan dalam produksi pupuk, deterjen, dan pendingin.
Dampak Asam dan Basa pada Lingkungan
Asam dan basa merupakan zat kimia yang dapat berdampak signifikan terhadap lingkungan. Asam kuat dan asam lemah dapat mempengaruhi ekosistem akuatik, tanah, dan atmosfer, sementara basa kuat dan basa lemah juga dapat menimbulkan dampak lingkungan.
Dampak Asam Kuat dan Asam Lemah
Asam kuat, seperti asam sulfat (H2SO4) dan asam nitrat (HNO3), dapat menurunkan pH air dan tanah, membuatnya lebih asam. Hal ini dapat berdampak negatif pada organisme akuatik, seperti ikan dan tumbuhan air, karena dapat merusak insang dan sel mereka. Selain itu, asam kuat dapat melarutkan logam dari tanah, mencemari air tanah dan permukaan.Asam
lemah, seperti asam asetat (CH3COOH) dan asam karbonat (H2CO3), memiliki dampak yang kurang parah dibandingkan asam kuat. Namun, asam lemah tetap dapat menurunkan pH air dan tanah, yang dapat berdampak pada pertumbuhan tanaman dan aktivitas mikroba.
Dampak Basa Kuat dan Basa Lemah
Basa kuat, seperti natrium hidroksida (NaOH) dan kalium hidroksida (KOH), dapat meningkatkan pH air dan tanah, membuatnya lebih basa. Hal ini dapat berbahaya bagi organisme akuatik, karena dapat merusak membran sel mereka. Basa kuat juga dapat bereaksi dengan logam, membentuk senyawa logam hidroksida yang dapat mengendap dan mencemari air.Basa
lemah, seperti amonia (NH3) dan natrium bikarbonat (NaHCO3), memiliki dampak yang kurang parah dibandingkan basa kuat. Namun, basa lemah tetap dapat meningkatkan pH air dan tanah, yang dapat mempengaruhi pertumbuhan tanaman dan aktivitas mikroba.
Keamanan Penanganan Asam dan Basa
Asam kuat dan basa kuat dapat menimbulkan bahaya signifikan saat ditangani. Oleh karena itu, sangat penting untuk memahami tindakan pencegahan keselamatan dan prosedur penanganan yang tepat.
Tindakan Pencegahan Saat Menangani Asam Kuat dan Basa Kuat
Tindakan pencegahan penting saat menangani asam kuat dan basa kuat meliputi:
- Kenakan alat pelindung diri (APD) yang sesuai, termasuk sarung tangan tahan bahan kimia, jas lab, pelindung mata, dan sepatu keselamatan.
- Bekerja di area yang berventilasi baik untuk menghindari paparan uap.
- Hindari kontak langsung dengan kulit dan mata.
- Jangan menghirup uap atau kabut.
- Jauhkan dari bahan yang tidak kompatibel, seperti logam, karena dapat menimbulkan reaksi berbahaya.
- Simpan dalam wadah yang sesuai dan beri label dengan jelas.
Prosedur Keselamatan untuk Bekerja dengan Asam dan Basa di Laboratorium
Saat bekerja dengan asam dan basa di laboratorium, ikuti prosedur keselamatan berikut:
- Baca dan pahami lembar data keselamatan bahan (MSDS) untuk bahan yang digunakan.
- Rencanakan dan siapkan semua peralatan dan bahan yang diperlukan sebelum memulai eksperimen.
- Gunakan alat ukur yang tepat dan pastikan peralatan dalam kondisi baik.
- Tambahkan asam ke air, bukan sebaliknya, untuk menghindari reaksi percikan.
- Encerkan asam dan basa secara bertahap untuk mengontrol panas yang dihasilkan.
- Bersihkan tumpahan segera dan netralkan dengan bahan yang sesuai.
- Buang limbah dengan benar sesuai dengan peraturan yang berlaku.
Ringkasan Akhir

Sifat dan perilaku asam kuat, asam lemah, basa kuat, dan basa lemah sangat penting untuk dipahami dalam berbagai bidang. Pemahaman ini memungkinkan kita mengoptimalkan proses industri, mengembangkan pengobatan baru, dan mengatasi masalah lingkungan. Dengan memanipulasi kekuatan dan konsentrasi asam dan basa, kita dapat mengendalikan reaksi kimia, menciptakan bahan baru, dan melindungi ekosistem kita.
Penelitian berkelanjutan di bidang ini terus memperluas pengetahuan kita tentang peran penting asam dan basa dalam dunia kita.
Pertanyaan yang Sering Diajukan
Apa perbedaan utama antara asam kuat dan asam lemah?
Asam kuat terdisosiasi sempurna dalam air, melepaskan semua protonnya, sedangkan asam lemah hanya terdisosiasi sebagian.
Bagaimana konsentrasi mempengaruhi disosiasi asam dan basa?
Konsentrasi yang lebih tinggi umumnya mengarah pada disosiasi yang lebih tinggi untuk asam dan basa.
Apa saja contoh penggunaan asam kuat dalam kehidupan sehari-hari?
Asam kuat seperti asam sulfat digunakan dalam baterai mobil dan asam klorida digunakan untuk membersihkan kamar mandi.
Bagaimana basa lemah dapat bermanfaat dalam aplikasi industri?
Basa lemah seperti amonia digunakan dalam pupuk dan sebagai bahan pembersih.