Dalam dunia fisika dan kimia, kalorimeter berperan penting dalam mengukur panas yang terlibat dalam reaksi kimia dan perubahan fisika. Instrumen canggih ini memungkinkan para ilmuwan untuk menyelidiki sifat termodinamika berbagai zat dan proses.
Artikel ini akan mengulas secara komprehensif cara kerja kalorimeter, mengeksplorasi prinsip kerjanya, jenis-jenisnya, prosedur pengukuran, dan beragam aplikasinya dalam berbagai bidang ilmiah.
Pengertian Kalorimeter
Kalorimeter adalah alat yang digunakan untuk mengukur jumlah panas yang diserap atau dilepaskan oleh suatu zat atau reaksi kimia. Prinsip kerja kalorimeter didasarkan pada prinsip konservasi energi, yang menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya dapat ditransfer atau diubah bentuknya.
Dalam kalorimeter, panas yang diserap atau dilepaskan oleh zat atau reaksi kimia menyebabkan perubahan suhu pada kalorimeter. Perubahan suhu ini diukur dan digunakan untuk menghitung jumlah panas yang dipertukarkan.
Jenis-Jenis Kalorimeter
Terdapat berbagai jenis kalorimeter yang digunakan untuk mengukur panas, antara lain:
- Kalorimeter Bom: Digunakan untuk mengukur panas pembakaran zat.
- Kalorimeter Isoperibol: Digunakan untuk mengukur panas reaksi pada volume konstan.
- Kalorimeter Adiabatik: Digunakan untuk mengukur panas reaksi pada kondisi terisolasi.
- Kalorimeter Diferensial Pemindaian (DSC): Digunakan untuk mengukur perubahan panas pada suatu zat sebagai fungsi suhu.
- Kalorimeter Fluks Panas: Digunakan untuk mengukur laju perpindahan panas melalui suatu permukaan.
Cara Kerja Kalorimeter

Kalorimeter adalah alat yang digunakan untuk mengukur jumlah panas yang dilepaskan atau diserap oleh suatu reaksi atau proses. Kalorimeter bekerja berdasarkan prinsip kesetimbangan panas, di mana panas yang dilepaskan oleh suatu reaksi atau proses akan diserap oleh kalorimeter dan menyebabkan peningkatan suhunya.
Jenis Kalorimeter
Terdapat beberapa jenis kalorimeter, antara lain:
- Kalorimeter Bom: Digunakan untuk mengukur panas pembakaran bahan bakar.
- Kalorimeter Air: Digunakan untuk mengukur panas yang dilepaskan atau diserap oleh reaksi dalam air.
- Kalorimeter Es: Digunakan untuk mengukur panas yang dilepaskan atau diserap oleh reaksi yang terjadi pada es.
- Kalorimeter Kalorimetri Adiabatik: Digunakan untuk mengukur panas yang dilepaskan atau diserap oleh reaksi yang terjadi pada kondisi adiabatik (tanpa pertukaran panas dengan lingkungan).
Prinsip Kerja
Prinsip kerja kalorimeter secara umum adalah sebagai berikut:
- Reaksi atau proses yang ingin diukur panasnya ditempatkan dalam kalorimeter.
- Kalorimeter dan isinya diisolasi agar tidak terjadi pertukaran panas dengan lingkungan.
- Panas yang dilepaskan atau diserap oleh reaksi atau proses akan diserap oleh kalorimeter, sehingga menyebabkan peningkatan suhu kalorimeter.
- Perubahan suhu kalorimeter diukur menggunakan termometer.
- Jumlah panas yang dilepaskan atau diserap dihitung berdasarkan perubahan suhu kalorimeter dan kapasitas kalor kalorimeter.
Kegunaan
Kalorimeter memiliki berbagai kegunaan, antara lain:
- Mengukur panas pembakaran bahan bakar.
- Mengukur panas yang dilepaskan atau diserap oleh reaksi kimia.
- Menentukan kapasitas kalor zat.
- Mengukur perubahan entalpi suatu reaksi.
Faktor-Faktor yang Mempengaruhi Akurasi Pengukuran Kalorimeter
Akurasi pengukuran kalorimeter dipengaruhi oleh beberapa faktor, antara lain:
- Kapasitas kalor kalorimeter: Semakin besar kapasitas kalor kalorimeter, semakin kecil perubahan suhu yang terjadi untuk jumlah panas yang sama.
- Insulasi kalorimeter: Insulasi yang baik akan meminimalkan pertukaran panas dengan lingkungan.
- Akurasi termometer: Termometer yang akurat akan memberikan pengukuran perubahan suhu yang lebih tepat.
- Kehilangan panas melalui konduksi, konveksi, dan radiasi: Kehilangan panas ini dapat menyebabkan kesalahan dalam pengukuran.
- Reaksi samping: Reaksi samping yang terjadi dalam kalorimeter dapat menghasilkan panas atau menyerap panas, sehingga mempengaruhi pengukuran.
Prosedur Pengukuran Kalorimeter
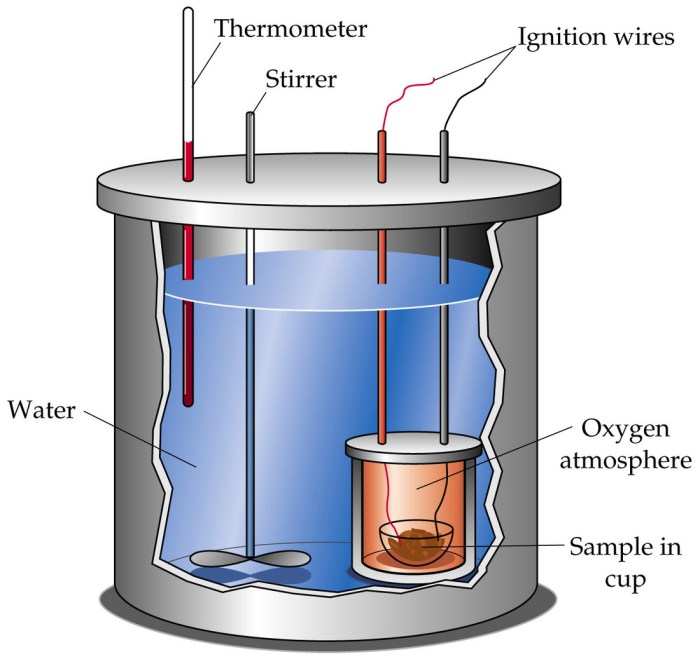
Prosedur pengukuran kalorimeter melibatkan langkah-langkah sistematis untuk menentukan kapasitas kalor dan perubahan entalpi reaksi.
Variabel yang diukur meliputi:
- Suhu awal dan akhir kalorimeter
- Massa sampel dan kalorimeter
- Jumlah panas yang ditambahkan atau dilepaskan selama reaksi
Data ini diolah menggunakan rumus kapasitas kalor spesifik dan perubahan entalpi berikut:
C = Q / (m
ΔT)
di mana:
- C adalah kapasitas kalor spesifik (J/g°C)
- Q adalah jumlah panas (J)
- m adalah massa sampel (g)
- ΔT adalah perubahan suhu (°C)
ΔH =
Q
di mana:
- ΔH adalah perubahan entalpi (J)
- Q adalah jumlah panas (J)
Aplikasi Kalorimeter

Kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat dalam reaksi kimia atau perubahan fisika. Aplikasi kalorimeter sangat luas dalam berbagai bidang, termasuk kimia, fisika, dan biologi.
Kimia
- Penentuan Entalpi Reaksi: Kalorimeter digunakan untuk mengukur entalpi perubahan kimia, yang merupakan jumlah kalor yang dilepaskan atau diserap selama reaksi.
- Penentuan Kapasitas Kalor Spesifik: Kalorimeter dapat digunakan untuk mengukur kapasitas kalor spesifik suatu zat, yang merupakan jumlah kalor yang dibutuhkan untuk menaikkan suhu zat sebesar 1 derajat Celcius.
Fisika
- Penentuan Kalor Laten: Kalorimeter digunakan untuk mengukur kalor laten suatu zat, yang merupakan jumlah kalor yang diserap atau dilepaskan selama perubahan fasa (misalnya, padat ke cair atau cair ke gas).
- Penentuan Konduktivitas Termal: Kalorimeter dapat digunakan untuk mengukur konduktivitas termal suatu zat, yang merupakan kemampuannya menghantarkan kalor.
Biologi
- Pengukuran Metabolisme: Kalorimeter dapat digunakan untuk mengukur laju metabolisme organisme, yang merupakan jumlah kalor yang dihasilkan per satuan waktu.
- Penentuan Nilai Kalori Makanan: Kalorimeter dapat digunakan untuk menentukan nilai kalori makanan, yang merupakan jumlah kalor yang dilepaskan ketika makanan dicerna.
Ilustrasi dan Contoh
Prinsip kerja kalorimeter dapat diilustrasikan melalui diagram berikut:
Diagram menunjukkan sebuah wadah terisolasi dengan sampel uji di dalamnya. Sensor suhu ditempatkan di dalam wadah untuk mengukur perubahan suhu. Kalorimeter dihubungkan ke sumber panas atau dingin untuk mengatur suhu wadah.
Contoh Penggunaan Kalorimeter dalam Penelitian
“Kalorimeter banyak digunakan dalam penelitian untuk mengukur kapasitas panas spesifik suatu zat, perubahan entalpi reaksi, dan menentukan nilai kalor reaksi. Kalorimeter memainkan peran penting dalam bidang termokimia dan penelitian termodinamika.”
Sumber: Pengantar Termokimia, Atkins dan de Paula
Pemungkas

Dengan memahami prinsip dan aplikasi kalorimeter, para ilmuwan dapat memperoleh wawasan yang lebih dalam tentang perilaku energi dalam sistem kimia dan fisika. Kalorimeter terus menjadi alat yang sangat diperlukan dalam penelitian ilmiah, memungkinkan kita untuk mengungkap rahasia tersembunyi dari dunia termal.
Pertanyaan yang Sering Diajukan
Apa itu kalorimeter?
Kalorimeter adalah alat yang digunakan untuk mengukur perubahan panas yang terjadi dalam suatu reaksi atau proses.
Apa prinsip kerja kalorimeter?
Kalorimeter bekerja berdasarkan prinsip kesetimbangan panas, di mana panas yang dilepaskan atau diserap oleh suatu zat ditransfer ke lingkungan sekitarnya atau sumber panas eksternal.
Apa saja jenis-jenis kalorimeter?
Terdapat berbagai jenis kalorimeter, antara lain kalorimeter bom, kalorimeter larutan, dan kalorimeter diferensial pemindaian.