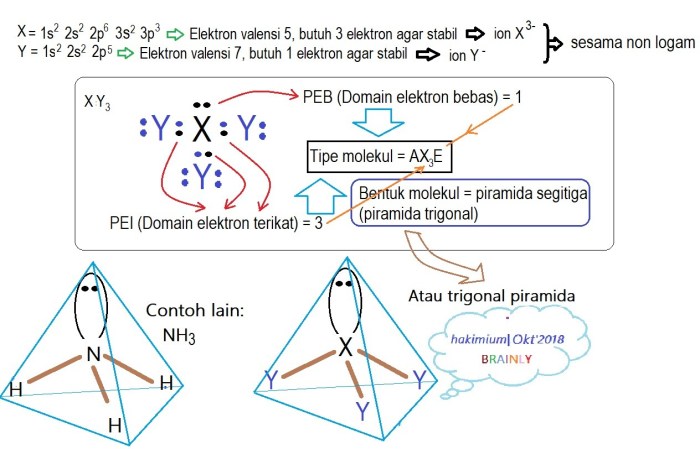
Dalam dunia kimia, kestabilan unsur merupakan konsep mendasar yang mengacu pada kemampuan suatu unsur untuk mempertahankan struktur dan sifatnya dalam kondisi tertentu. Faktor-faktor seperti jumlah elektron, konfigurasi elektron, dan energi ionisasi berperan penting dalam menentukan kestabilan unsur.
Untuk mencapai kestabilan, unsur dapat menggunakan berbagai metode, termasuk pembentukan ikatan, transfer elektron, dan mengikuti Aturan Oktet. Dengan memahami mekanisme ini, kita dapat memperoleh wawasan tentang perilaku unsur dan reaktivitasnya dalam reaksi kimia.
Definisi Kestabilan Unsur

Kestabilan unsur mengacu pada kemampuan unsur untuk mempertahankan konfigurasi elektron yang stabil. Konfigurasi stabil adalah keadaan di mana unsur memiliki energi terendah dan paling tidak reaktif.
Faktor-faktor yang mempengaruhi kestabilan unsur meliputi:
- Jumlah elektron valensi
- Ukuran dan muatan inti
- Konfigurasi elektron
Metode Pencapaian Kestabilan

Unsur-unsur mencapai kestabilan dengan berpartisipasi dalam reaksi kimia yang menghasilkan konfigurasi elektron yang lebih stabil. Ada dua metode utama yang digunakan untuk mencapai kestabilan ini: pembentukan ikatan dan transfer elektron.
Pembentukan Ikatan
Pembentukan ikatan melibatkan berbagi atau transfer elektron antar atom. Ketika atom berbagi elektron, mereka membentuk ikatan kovalen. Dalam ikatan kovalen, setiap atom menyumbangkan satu atau lebih elektron ke orbital molekul yang dimiliki bersama.Contoh pembentukan ikatan kovalen dapat dilihat pada pembentukan molekul hidrogen (H2).
Setiap atom hidrogen menyumbangkan satu elektron ke orbital molekul yang dimiliki bersama, membentuk ikatan kovalen tunggal.
Transfer Elektron
Transfer elektron melibatkan transfer satu atau lebih elektron dari satu atom ke atom lainnya. Ketika elektron ditransfer, atom yang kehilangan elektron menjadi bermuatan positif (ion positif), sedangkan atom yang menerima elektron menjadi bermuatan negatif (ion negatif).Contoh transfer elektron dapat dilihat pada pembentukan ion natrium (Na+) dan klorida (Cl-).
Atom natrium kehilangan satu elektron ke atom klor, menghasilkan ion natrium bermuatan positif dan ion klorida bermuatan negatif.
Aturan Oktet
Aturan Oktet adalah prinsip kimia yang menyatakan bahwa unsur-unsur cenderung memperoleh atau kehilangan elektron untuk mencapai konfigurasi elektron yang stabil dengan delapan elektron valensi (elektron pada kulit terluar).
Aturan ini didasarkan pada pengamatan bahwa gas mulia, yang sangat stabil secara kimia, memiliki delapan elektron valensi. Oleh karena itu, unsur-unsur lain cenderung bereaksi dengan cara yang memperoleh atau kehilangan elektron untuk mencapai konfigurasi yang mirip dengan gas mulia.
Contoh Unsur yang Mengikuti Aturan Oktet
- Helium (2 elektron valensi)
- Neon (8 elektron valensi)
- Argon (8 elektron valensi)
- Natrium (1 elektron valensi, kehilangan 1 elektron untuk mencapai 8 elektron valensi)
- Klorin (7 elektron valensi, memperoleh 1 elektron untuk mencapai 8 elektron valensi)
Transfer Elektron

Transfer elektron adalah proses perpindahan elektron dari satu atom atau molekul ke atom atau molekul lain. Ini merupakan mekanisme penting yang digunakan oleh unsur-unsur untuk mencapai kestabilan elektron, yaitu keadaan di mana unsur memiliki jumlah elektron yang optimal pada kulit valensinya.
Transfer elektron terjadi ketika ada perbedaan elektronegativitas antara dua atom atau molekul. Elektronegativitas adalah ukuran kemampuan suatu atom untuk menarik elektron. Ketika dua atom dengan elektronegativitas yang berbeda berinteraksi, atom dengan elektronegativitas lebih tinggi akan menarik elektron dari atom dengan elektronegativitas lebih rendah.
Contoh Reaksi Kimia
- Reaksi antara natrium (Na) dan klorin (Cl):
Dalam reaksi ini, natrium (Na) memiliki elektronegativitas lebih rendah daripada klorin (Cl), sehingga elektron dari natrium ditransfer ke klorin. Hasilnya adalah pembentukan senyawa natrium klorida (NaCl), yang memiliki struktur elektron yang stabil.2 Na + Cl 2 → 2 NaCl
- Reaksi antara kalsium (Ca) dan oksigen (O):
Dalam reaksi ini, kalsium (Ca) memiliki elektronegativitas lebih rendah daripada oksigen (O), sehingga elektron dari kalsium ditransfer ke oksigen.2 Ca + O 2 → 2 CaO
Hasilnya adalah pembentukan senyawa kalsium oksida (CaO), yang memiliki struktur elektron yang stabil.
Pembentukan Ikatan
Pembentukan ikatan merupakan proses krusial dalam mencapai kestabilan unsur. Unsur-unsur cenderung berikatan untuk mendapatkan konfigurasi elektron yang lebih stabil, yang menyerupai konfigurasi gas mulia.
Jenis Ikatan Kimia
- Ikatan Ionik: Terjadi antara unsur logam (donor elektron) dan non-logam (akseptor elektron). Unsur logam melepaskan elektron, membentuk ion positif (kation), sementara unsur non-logam menerima elektron, membentuk ion negatif (anion). Ikatan ionik dibentuk oleh gaya tarik elektrostatik antara ion-ion bermuatan berlawanan.
- Ikatan Kovalen: Terjadi antara dua atau lebih atom non-logam. Atom-atom berbagi pasangan elektron, membentuk ikatan kovalen. Ikatan ini terbentuk ketika atom-atom memiliki perbedaan elektronegativitas yang kecil, sehingga tidak ada atom yang mampu menarik elektron sepenuhnya.
Kontribusi Pembentukan Ikatan pada Kestabilan Unsur
Pembentukan ikatan berkontribusi pada kestabilan unsur dengan beberapa cara:
- Konfigurasi Elektron Stabil: Ikatan memungkinkan unsur mencapai konfigurasi elektron yang lebih stabil, seperti konfigurasi gas mulia. Konfigurasi ini memiliki orbital terluar yang terisi penuh, yang sangat stabil.
- Penurunan Energi Potensial: Pembentukan ikatan melepaskan energi, yang menurunkan energi potensial keseluruhan sistem. Energi yang dilepaskan ini membantu menstabilkan unsur.
- Interaksi Elektrostatik: Dalam ikatan ionik, gaya tarik elektrostatik antara ion-ion yang bermuatan berlawanan menstabilkan struktur kristal. Dalam ikatan kovalen, pasangan elektron yang dibagikan menciptakan medan elektron negatif yang menolak elektron lain, sehingga menstabilkan ikatan.
Resonansi dan Delokalisasi Elektron
Resonansi adalah fenomena di mana suatu molekul atau ion dapat direpresentasikan oleh beberapa struktur Lewis yang berbeda, namun dengan distribusi elektron yang sama. Struktur-struktur ini disebut struktur resonansi.
Delokalisasi elektron mengacu pada penyebaran elektron di atas beberapa atom dalam suatu molekul atau ion, bukan terlokalisasi pada atom tertentu. Resonansi menyebabkan delokalisasi elektron, yang pada akhirnya meningkatkan kestabilan unsur.
Pengaruh Resonansi dan Delokalisasi Elektron terhadap Kestabilan Unsur
- Meningkatkan energi resonansi: Struktur resonansi yang berbeda berkontribusi pada energi keseluruhan molekul. Semakin banyak struktur resonansi, semakin rendah energi resonansi dan semakin stabil molekul tersebut.
- Mengurangi kerapatan elektron: Delokalisasi elektron mengurangi kerapatan elektron pada atom tertentu, yang mengurangi tolakan elektron dan meningkatkan kestabilan.
- Menurunkan reaktivitas: Molekul atau ion yang mengalami resonansi dan delokalisasi elektron cenderung kurang reaktif karena elektronnya kurang tersedia untuk berpartisipasi dalam reaksi kimia.
Kestabilan dalam Senyawa

Kestabilan suatu senyawa adalah ukuran seberapa reaktif senyawa tersebut. Senyawa yang stabil tidak reaktif dan cenderung mempertahankan struktur kimianya, sedangkan senyawa yang tidak stabil sangat reaktif dan cenderung bereaksi dengan senyawa lain.
Faktor yang Mempengaruhi Kestabilan Senyawa
Beberapa faktor yang mempengaruhi kestabilan senyawa meliputi:
- Jenis ikatan kimia
- Struktur molekul
- Muatan formal
- Entalpi pembentukan
Ilustrasi Stabilitas Senyawa
Ilustrasi berikut menunjukkan stabilitas relatif senyawa yang berbeda:
| Senyawa | Kestabilan |
|---|---|
| NaCl | Stabil |
| CO | Stabil |
| H2O | Relatif stabil |
| NH3 | Relatif tidak stabil |
| CH4 | Tidak stabil |
Terakhir
Pencapaian kestabilan unsur sangat penting untuk memahami sifat kimia dan reaktifnya. Dengan mengeksplorasi berbagai metode yang digunakan unsur untuk mencapai kestabilan, kita dapat memperoleh pemahaman yang lebih mendalam tentang dasar-dasar kimia dan memprediksi perilaku unsur dalam berbagai situasi.
Sudut Pertanyaan Umum (FAQ)
Apa faktor yang mempengaruhi kestabilan unsur?
Jumlah elektron, konfigurasi elektron, dan energi ionisasi.
Jelaskan bagaimana transfer elektron berkontribusi pada kestabilan unsur.
Transfer elektron dapat menyebabkan unsur memperoleh konfigurasi elektron yang stabil, seperti konfigurasi gas mulia.
Berikan contoh reaksi kimia yang melibatkan resonansi.
Resonansi dapat diamati dalam molekul benzena, di mana elektron terdelokalisasi dalam struktur cincin.