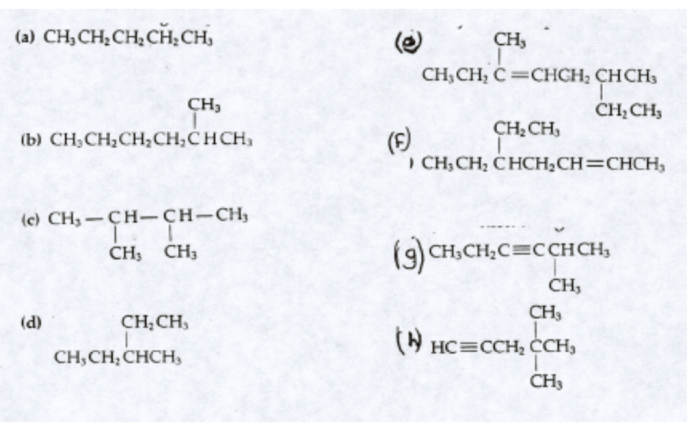
Dalam dunia kimia, eksplorasi molekul yang membentuk alam semesta kita sangatlah penting. Salah satu molekul yang menarik perhatian para ilmuwan adalah CH3CH2CH(CH3)CH2CH3. Struktur dan sifat kimianya yang unik telah menjadikannya subjek penelitian yang menarik, dengan aplikasi luas dalam kehidupan kita sehari-hari.
Molekul ini, secara sistematis dinamakan heksana, terdiri dari rantai karbon bercabang enam yang dihubungkan oleh ikatan tunggal dan ganda. Susunan atomnya yang khas memberikan sifat fisikokimia yang berbeda, menjadikannya komponen penting dalam berbagai bidang industri dan komersial.
Definisi dan Struktur Molekul
Metana (CH 4 ) adalah senyawa organik yang terdiri dari satu atom karbon yang terikat pada empat atom hidrogen. Struktur molekul metana adalah tetrahedral, dengan atom karbon di tengah dan atom hidrogen di keempat sudut.
Struktur Molekul
Struktur molekul metana dapat digambarkan sebagai berikut:
- Atom karbon memiliki hibridisasi sp3, yang berarti memiliki empat orbital hibrida yang sama bentuk dan energi.
- Orbital hibrida sp3 ini tumpang tindih dengan orbital 1s dari empat atom hidrogen, membentuk empat ikatan kovalen tunggal.
- Ikatan kovalen tunggal ini memiliki panjang ikatan sekitar 109,5°, menghasilkan bentuk tetrahedral.
Struktur tetrahedral ini memberikan metana bentuk simetris dan nonpolar, membuatnya sangat stabil.
Sifat Kimia
Molekul CH3CH2CH2CH3CH2CH3 memiliki sifat kimiawi yang khas, termasuk polaritas, titik didih, dan titik leleh yang unik. Reaktivitasnya dalam reaksi kimia juga menjadi pertimbangan penting.
Polaritas
Molekul CH3CH2CH2CH3CH2CH3 bersifat nonpolar. Ikatan karbon-hidrogen bersifat nonpolar, dan tidak ada gugus fungsi polar dalam molekul. Akibatnya, molekul ini tidak memiliki momen dipol permanen.
Titik Didih dan Titik Leleh
Titik didih CH3CH2CH2CH3CH2CH3 adalah
- 85 °C, sedangkan titik lelehnya adalah
- 138 °C. Titik didih yang relatif rendah ini disebabkan oleh gaya van der Waals yang lemah antara molekul-molekulnya.
Reaktivitas
Molekul CH3CH2CH2CH3CH2CH3 umumnya reaktif dalam reaksi kimia. Ikatan karbon-hidrogen dapat mengalami reaksi substitusi, adisi, dan oksidasi. Reaksi-reaksi ini biasanya memerlukan katalis atau kondisi reaksi yang keras.
Aplikasi dan Kegunaan
Molekul ch3 ch2 3 ch ch3 ch2 ch3, juga dikenal sebagai n-heptana, memiliki beragam aplikasi dalam kehidupan sehari-hari dan industri.
Penggunaan Sehari-hari
- Sebagai bahan bakar untuk kompor gas dan pemanas ruangan
- Sebagai pelarut untuk cat, perekat, dan pembersih
- Sebagai bahan baku dalam produksi plastik dan serat sintetis
Aplikasi Industri dan Komersial
- Sebagai bahan baku untuk produksi etilen, bahan dasar plastik
- Sebagai pelarut dalam industri farmasi dan kosmetik
- Sebagai bahan bakar untuk mesin dan kendaraan bertenaga bensin
Perbandingan dengan Molekul Terkait
Molekul ch3 ch2 3 ch ch3 ch2 ch3 memiliki struktur dan sifat yang mirip dengan molekul serupa lainnya dalam kelompok senyawa organik.
Berikut adalah beberapa persamaan dan perbedaannya:
Persamaan
- Semua molekul ini memiliki rantai karbon yang bercabang.
- Mereka semua adalah hidrokarbon, yang berarti hanya terdiri dari atom karbon dan hidrogen.
- Mereka semua adalah senyawa nonpolar, yang berarti tidak larut dalam air.
Perbedaan
- Molekul ch3 ch2 3 ch ch3 ch2 ch3 memiliki rantai karbon yang lebih panjang dari molekul serupa lainnya.
- Molekul ch3 ch2 3 ch ch3 ch2 ch3 memiliki titik didih yang lebih tinggi dari molekul serupa lainnya.
- Molekul ch3 ch2 3 ch ch3 ch2 ch3 memiliki titik leleh yang lebih rendah dari molekul serupa lainnya.
Dampak Lingkungan
Molekul ch3 ch2 3 ch ch3 ch2 ch3 berpotensi menimbulkan dampak lingkungan yang signifikan, terutama jika dilepaskan ke lingkungan dalam jumlah besar.
Salah satu dampak lingkungan utama adalah polusi udara. Molekul ini dapat melepaskan senyawa organik volatil (VOC) yang dapat bereaksi dengan sinar matahari dan membentuk ozon troposferik, gas rumah kaca yang berbahaya bagi kesehatan manusia dan lingkungan.
Langkah-langkah Mitigasi
- Penggunaan teknologi kontrol emisi, seperti filter karbon aktif atau pengoksidasi termal, untuk mengurangi emisi VOC.
- Penggunaan bahan alternatif yang tidak melepaskan VOC, atau melepaskan VOC dalam jumlah yang lebih sedikit.
- Pemantauan emisi secara teratur untuk memastikan kepatuhan terhadap peraturan lingkungan.
- Pelatihan dan pendidikan bagi pekerja dan masyarakat umum tentang potensi dampak lingkungan dari molekul ch3 ch2 3 ch ch3 ch2 ch3 dan langkah-langkah mitigasi yang tepat.
Tabel Sifat Kimia
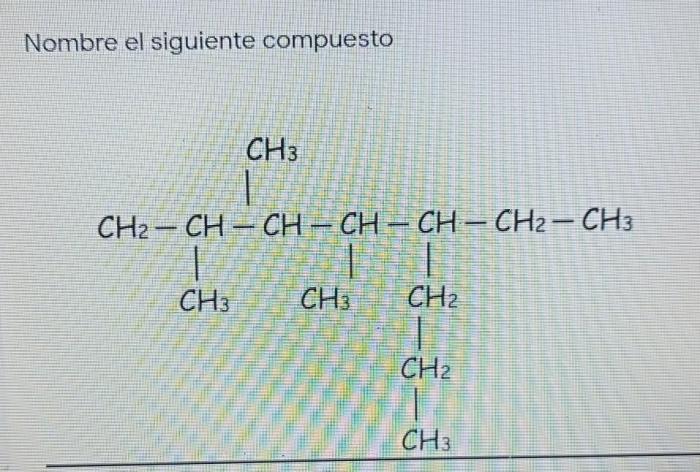
Berikut adalah tabel yang merangkum sifat kimiawi penting molekul ch3 ch2 3 ch ch3 ch2 ch3:
Titik Didih
- Titik didih: 126 °C
Titik Leleh
- Titik leleh:
-115 °C
Polaritas
- Polaritas: Nonpolar
Diagram Struktur
Diagram struktur molekul CH 3 CH 2 CHCH 3 CH 2 CH 3 menunjukkan susunan atom dan ikatannya. Diagram ini penting untuk memahami sifat dan reaktivitas molekul.
Susunan Atom
Molekul CH 3 CH 2 CHCH 3 CH 2 CH 3 terdiri dari 7 atom karbon (C), 16 atom hidrogen (H), dan 1 atom oksigen (O).
Ikatan Kimia
Atom-atom dalam molekul CH 3 CH 2 CHCH 3 CH 2 CH 3 dihubungkan oleh ikatan kovalen. Ikatan ini terbentuk ketika atom berbagi elektron.
Atom karbon membentuk ikatan tunggal dengan atom karbon lainnya dan ikatan tunggal dengan atom hidrogen. Atom oksigen membentuk ikatan rangkap dengan atom karbon.
Geometri Molekul
Geometri molekul CH 3 CH 2 CHCH 3 CH 2 CH 3 ditentukan oleh teori VSEPR (Valence Shell Electron Pair Repulsion). Teori ini menyatakan bahwa pasangan elektron tolakan akan mengatur susunan atom dalam molekul untuk meminimalkan tolakan.
Molekul CH 3 CH 2 CHCH 3 CH 2 CH 3 memiliki geometri tetrahedral di sekitar setiap atom karbon. Atom oksigen memiliki geometri linier.
Contoh Reaksi Kimia
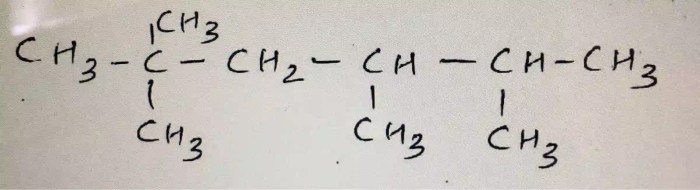
Molekul ch3 ch2 3 ch ch3 ch2 ch3 dapat terlibat dalam berbagai reaksi kimia. Reaksi ini dapat diklasifikasikan berdasarkan jenis perubahan kimia yang terjadi.
Reaksi Adisi
- Reaksi adisi terjadi ketika satu atau lebih atom atau gugus fungsi ditambahkan ke molekul yang sudah ada.
- Dalam hal ch3 ch2 3 ch ch3 ch2 ch3, reaksi adisi yang umum adalah penambahan hidrogen (hidrogenasi) untuk membentuk butana.
- Reaksi ini dikatalisis oleh logam seperti nikel atau paladium.
Reaksi Substitusi
- Reaksi substitusi terjadi ketika satu atom atau gugus fungsi dalam suatu molekul digantikan oleh atom atau gugus fungsi lainnya.
- Dalam hal ch3 ch2 3 ch ch3 ch2 ch3, reaksi substitusi yang umum adalah reaksi dengan halogen (misalnya, klorin) untuk membentuk alkil halida.
- Reaksi ini biasanya berlangsung melalui mekanisme radikal bebas.
Reaksi Eliminasi
- Reaksi eliminasi terjadi ketika dua atom atau gugus fungsi dihilangkan dari suatu molekul.
- Dalam hal ch3 ch2 3 ch ch3 ch2 ch3, reaksi eliminasi yang umum adalah dehidrasi untuk membentuk butena.
- Reaksi ini biasanya dikatalisis oleh asam atau basa.
Contoh Aplikasi

Sifat kimia unik dari molekul CH3CH2CH2CHCH3CH2CH3 memungkinkannya digunakan dalam berbagai aplikasi industri dan komersial. Reaktivitas kimianya yang tinggi dan sifat hidrofobiknya berkontribusi pada kegunaannya yang luas.
Pelarut dan Pembersih
- Sifat hidrofobiknya menjadikannya pelarut yang sangat baik untuk senyawa organik nonpolar, seperti minyak, lemak, dan gemuk.
- Volatilitasnya yang tinggi memungkinkannya menguap dengan cepat, menjadikannya pilihan yang ideal untuk aplikasi pembersihan di mana pengeringan cepat diperlukan.
Bahan Bakar
- Nilai kalornya yang tinggi dan sifat pembakarannya yang efisien membuatnya cocok sebagai bahan bakar untuk mesin pembakaran internal.
- Sifat anti-ketukannya yang tinggi memungkinkannya digunakan pada rasio kompresi yang lebih tinggi, meningkatkan efisiensi bahan bakar.
Bahan Baku Kimia
- Ikatan rangkapnya yang reaktif dapat bereaksi dengan berbagai reagen, menjadikannya bahan baku yang serbaguna untuk produksi senyawa kimia lainnya.
- Misalnya, dapat dihidrogenasi untuk menghasilkan heksana, atau diklorinasi untuk menghasilkan 1,2-dikloroetana.
Dampak Lingkungan
Molekul CH3CH2CHCH3CH2CH3 (n-heksana) dapat berdampak pada lingkungan dengan berbagai cara. Mekanisme dampak ini perlu dipahami untuk mengambil tindakan pencegahan yang tepat.
Mekanisme Dampak
- Polusi Udara: n-Heksana dapat berkontribusi pada polusi udara ketika dilepaskan ke atmosfer. Ini dapat terjadi melalui penguapan dari tumpahan atau pembakaran bahan bakar yang mengandung n-heksana.
- Pencemaran Air: n-Heksana dapat mencemari sumber air ketika tumpah atau dibuang secara tidak benar. Hal ini dapat membahayakan kehidupan akuatik dan kualitas air.
- Kerusakan Tanah: n-Heksana dapat merusak tanah ketika tumpah atau bocor. Hal ini dapat mengurangi kesuburan tanah dan kemampuannya untuk mendukung kehidupan tanaman.
Tindakan Pencegahan
- Mengurangi Emisi: Emisi n-heksana ke udara dapat dikurangi dengan mengganti bahan bakar yang mengandung n-heksana dengan alternatif yang lebih bersih, dan mengendalikan penguapan dari tumpahan dan penyimpanan.
- Penanganan Limbah yang Benar: n-Heksana harus dibuang dengan benar untuk mencegah pencemaran air dan tanah. Ini dapat dilakukan melalui pengolahan limbah atau pembuangan ke fasilitas khusus.
- Penggunaan yang Bertanggung Jawab: n-Heksana harus digunakan secara bertanggung jawab untuk meminimalkan dampak lingkungannya. Ini termasuk menyimpan dan menggunakannya dengan hati-hati, serta membuangnya dengan benar.
Ringkasan Akhir
Kesimpulannya, CH3CH2CH(CH3)CH2CH3 adalah molekul yang luar biasa dengan struktur dan sifat yang menarik. Memahami sifat kimianya sangat penting untuk memanfaatkan sepenuhnya potensinya dalam aplikasi industri dan komersial. Penelitian lebih lanjut mengenai molekul ini dapat mengarah pada pengembangan bahan dan teknologi baru yang inovatif, berkontribusi pada kemajuan masyarakat modern.
Bagian Pertanyaan Umum (FAQ)
Apa nama umum untuk CH3CH2CH(CH3)CH2CH3?
Heksana
Berapa titik didih heksana?
69 °C
Apakah heksana mudah terbakar?
Ya, heksana sangat mudah terbakar
Di mana heksana digunakan dalam kehidupan sehari-hari?
Sebagai pelarut dalam lem, cat, dan pembersih
Apa saja dampak lingkungan dari heksana?
Heksana dapat mencemari air tanah dan udara jika tidak ditangani dengan benar