Contoh garam dari asam lemah dan basa lemah – Dalam kimia, garam yang berasal dari asam lemah dan basa lemah memegang peran penting. Mereka menunjukkan sifat kimia yang unik, berdampak pada pH larutan, dan memiliki beragam aplikasi dalam berbagai bidang.
Asam lemah dan basa lemah menghasilkan garam dengan sifat yang berbeda dari asam kuat dan basa kuat. Garam-garam ini memiliki pengaruh yang signifikan pada lingkungan tempat mereka berada, mempengaruhi kesetimbangan kimia dan reaksi biologis.
Pengertian Garam dari Asam Lemah dan Basa Lemah
Garam dari asam lemah dan basa lemah adalah senyawa ionik yang terbentuk dari reaksi asam lemah dengan basa lemah. Reaksi ini menghasilkan ion-ion yang mengalami hidrolisis dalam air, sehingga larutan garam tersebut bersifat basa lemah atau asam lemah.
Reaksi pembentukan garam dari asam lemah dan basa lemah dapat dinyatakan sebagai berikut:
asam lemah + basa lemah → garam + air
Garam dari asam lemah dan basa lemah, seperti natrium asetat, biasanya memiliki pH yang hampir netral karena ionisasi yang tidak lengkap dari asam dan basa. Untuk memahami lebih lanjut tentang manajemen keuangan, pemahaman tentang langkah untuk menampilkan laporan arus kas sangat penting.
Laporan arus kas memberikan gambaran tentang aliran kas perusahaan, yang dapat memberikan wawasan berharga tentang kesehatan keuangannya. Kembali ke topik garam asam lemah dan basa lemah, sifat netralnya sering digunakan dalam penyangga untuk mempertahankan pH yang stabil dalam sistem biologis.
Contoh reaksi pembentukan garam dari asam lemah dan basa lemah adalah reaksi antara asam asetat (CH 3COOH) dengan amonia (NH 3):
CH3COOH + NH 3→ CH 3COONH 4+ H 2O
Garam yang dihasilkan dari reaksi ini adalah amonium asetat (CH 3COONH 4), yang bersifat basa lemah karena mengalami hidrolisis dalam air menghasilkan ion asetat (CH 3COO –) dan ion amonium (NH 4+).
Sifat-Sifat Garam dari Asam Lemah dan Basa Lemah
Garam dari asam lemah dan basa lemah memiliki sifat-sifat sebagai berikut:
- Larutan garam bersifat basa lemah atau asam lemah.
- Garam mengalami hidrolisis dalam air, menghasilkan ion-ion yang dapat bereaksi dengan air.
- Reaksi hidrolisis garam bersifat reversibel, sehingga konsentrasi ion-ion dalam larutan dapat berubah seiring waktu.
- Konstanta hidrolisis (K h) merupakan ukuran kekuatan hidrolisis garam. Semakin besar nilai K h, semakin kuat hidrolisis garam.
Penerapan Garam dari Asam Lemah dan Basa Lemah
Garam dari asam lemah dan basa lemah memiliki berbagai penerapan dalam kehidupan sehari-hari, antara lain:
- Sebagai penyangga pH, untuk menjaga kestabilan pH larutan.
- Sebagai bahan pembersih, karena sifat basa lemah atau asam lemahnya dapat membantu menghilangkan kotoran.
- Sebagai obat-obatan, misalnya garam amonium asetat digunakan sebagai diuretik.
Sifat-sifat Garam dari Asam Lemah dan Basa Lemah: Contoh Garam Dari Asam Lemah Dan Basa Lemah
Garam yang dihasilkan dari asam lemah dan basa lemah umumnya bersifat basa lemah dan larutannya mempunyai pH lebih besar dari 7. Sifat ini disebabkan oleh kemampuan ion garam tersebut untuk menghidrolisis air, menghasilkan ion OH –yang meningkatkan pH larutan.
Pengaruh pada pH Larutan
Ketika garam dari asam lemah dan basa lemah dilarutkan dalam air, terjadi reaksi hidrolisis yang menghasilkan ion OH –. Reaksi ini dapat digambarkan sebagai berikut:
- A –+ H 2O ⇌ HA + OH –
- B ++ H 2O ⇌ HB ++ OH –
Konsentrasi ion OH –yang dihasilkan menentukan pH larutan. Semakin tinggi konsentrasi ion OH –, semakin tinggi pH larutan.
Contoh Ilustrasi Sifat-sifat Garam
Beberapa contoh garam dari asam lemah dan basa lemah meliputi:
- Amonium asetat (CH 3COONH 4): garam dari asam asetat (asam lemah) dan amonia (basa lemah), larutannya memiliki pH sekitar 8,2.
- Natrium bikarbonat (NaHCO 3): garam dari asam karbonat (asam lemah) dan natrium hidroksida (basa lemah), larutannya memiliki pH sekitar 8,3.
- Magnesium karbonat (MgCO 3): garam dari asam karbonat (asam lemah) dan magnesium hidroksida (basa lemah), larutannya memiliki pH sekitar 9,5.
Contoh Garam dari Asam Lemah dan Basa Lemah
Garam dari asam lemah dan basa lemah memiliki sifat yang berbeda dengan garam dari asam kuat dan basa kuat. Garam-garam ini bersifat amfoter, artinya dapat bertindak sebagai asam atau basa dalam larutan.
Sifat Garam Asam Lemah dan Basa Lemah
Garam dari asam lemah dan basa lemah memiliki sifat-sifat berikut:
- Larutannya bersifat netral (pH = 7).
- Dapat terhidrolisis dalam air, menghasilkan asam lemah dan basa lemah.
- Tidak bereaksi dengan asam kuat atau basa kuat.
Contoh Garam Asam Lemah dan Basa Lemah
Berikut adalah beberapa contoh garam dari asam lemah dan basa lemah:
| Nama Garam | Rumus Kimia | Sifat |
|---|---|---|
| Amonium asetat | CH3COONH4 | Larutannya bersifat sedikit asam |
| Natrium bikarbonat | NaHCO3 | Larutannya bersifat sedikit basa |
| Kalsium karbonat | CaCO3 | Tidak larut dalam air |
Reaksi Kimia yang Melibatkan Garam dari Asam Lemah dan Basa Lemah
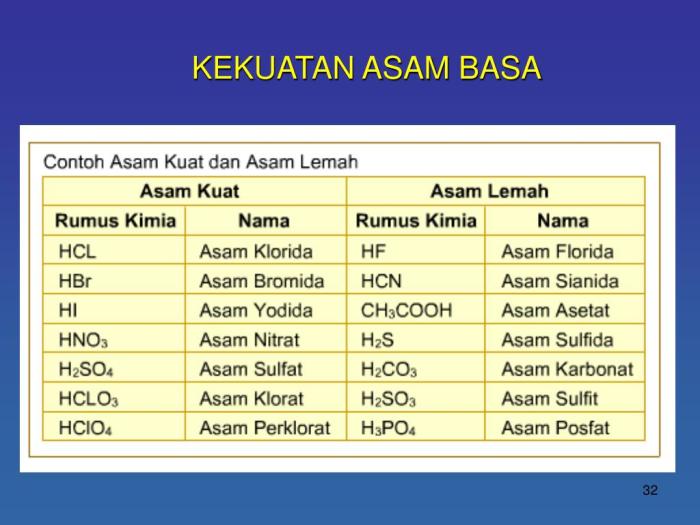
Garam dari asam lemah dan basa lemah dapat bereaksi dengan air untuk menghasilkan larutan yang bersifat asam atau basa. Sifat larutan ini bergantung pada kekuatan relatif asam dan basa yang membentuk garam tersebut.
Hidrolisis Garam, Contoh garam dari asam lemah dan basa lemah
Ketika garam dari asam lemah dan basa lemah dilarutkan dalam air, garam tersebut mengalami hidrolisis. Hidrolisis adalah reaksi kimia di mana air bereaksi dengan garam untuk menghasilkan asam dan basa. Reaksi hidrolisis dapat diwakili dengan persamaan berikut:
AB + H2O ⇌ HA + BOH
di mana AB adalah garam, HA adalah asam lemah, dan BOH adalah basa lemah.
Tingkat hidrolisis bergantung pada kekuatan asam dan basa yang membentuk garam. Jika asam lebih kuat dari basa, maka garam akan terhidrolisis lebih banyak untuk menghasilkan larutan asam. Jika basa lebih kuat dari asam, maka garam akan terhidrolisis lebih sedikit untuk menghasilkan larutan basa.
Contoh Reaksi Hidrolisis
Berikut adalah beberapa contoh reaksi hidrolisis garam dari asam lemah dan basa lemah:
- Natrium asetat (CH 3COONa) terhidrolisis dalam air untuk menghasilkan larutan basa karena asam asetat (CH 3COOH) lebih lemah dari basa natrium hidroksida (NaOH).
- Amonium klorida (NH 4Cl) terhidrolisis dalam air untuk menghasilkan larutan asam karena basa amonia (NH 3) lebih lemah dari asam klorida (HCl).
Penerapan Garam dari Asam Lemah dan Basa Lemah
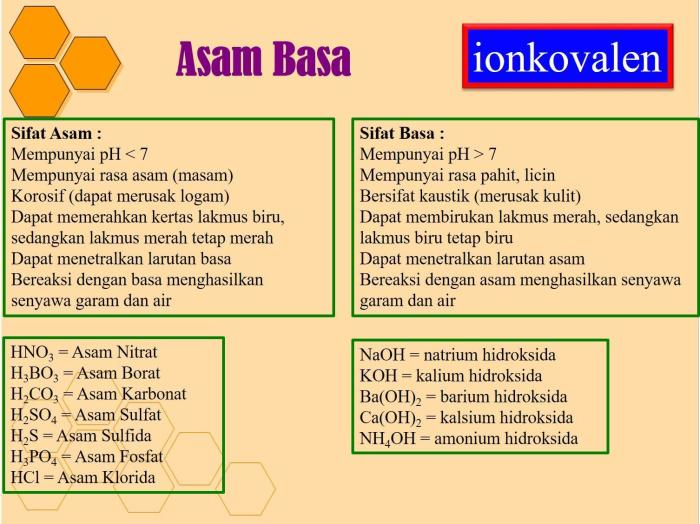
Garam dari asam lemah dan basa lemah memiliki berbagai penerapan dalam kehidupan sehari-hari, industri, dan bidang lainnya. Sifat-sifat uniknya, seperti kemampuan penyangga dan kelarutan, menjadikannya bahan yang berharga untuk berbagai keperluan.
Contoh garam dari asam lemah dan basa lemah, seperti asam asetat dan amonia, membentuk larutan penyangga yang dapat mempertahankan pH relatif stabil. Dalam lirik lagu “Melayani Melayani Lebih Sungguh” yang sarat makna pengabdian , kita menemukan semangat melayani dengan tulus dan ikhlas.
Demikian pula, garam dari asam lemah dan basa lemah memainkan peran penting dalam menjaga keseimbangan kimiawi, sehingga menciptakan lingkungan yang stabil dan harmonis.
Penggunaan dalam Industri
- Sebagai penyangga dalam larutan kimia, mempertahankan pH pada tingkat tertentu.
- Sebagai aditif dalam produk pembersih, memberikan sifat penyangga dan membantu menghilangkan kotoran.
- Dalam industri tekstil, digunakan untuk mewarnai dan memproses kain.
Penggunaan dalam Obat-obatan
- Sebagai antasida, menetralkan asam lambung dan meredakan sakit maag.
- Sebagai pencahar, meningkatkan motilitas usus dan meredakan sembelit.
- Dalam pengobatan mata, digunakan sebagai larutan penyangga untuk obat tetes mata.
Penggunaan Lainnya
- Sebagai aditif makanan, meningkatkan rasa dan mencegah pembusukan.
- Dalam pertanian, digunakan sebagai pupuk untuk memberikan nutrisi bagi tanaman.
- Dalam perawatan air, digunakan untuk menghilangkan logam berat dan kontaminan lainnya.
Meskipun serbaguna, garam dari asam lemah dan basa lemah juga memiliki keterbatasan tertentu. Sifat penyangganya yang terbatas dapat membuatnya tidak cocok untuk aplikasi yang membutuhkan penyangga yang lebih kuat. Selain itu, beberapa garam ini dapat bersifat korosif atau beracun, sehingga memerlukan penanganan yang tepat.
Dalam kimia, garam yang terbentuk dari asam lemah dan basa lemah, seperti asam asetat dan amonia, umumnya memiliki sifat basa lemah. Fenomena ini berkaitan dengan kesetimbangan asam-basa, di mana asam lemah cenderung tidak terionisasi secara sempurna dan basa lemah cenderung tidak menghasilkan ion hidroksida yang cukup.
Sementara itu, dalam konteks soal essay tentang etos kerja dalam islam , etos kerja yang kuat dipandang sebagai landasan spiritual yang mendorong produktivitas dan dedikasi. Sama seperti garam dari asam lemah dan basa lemah yang memiliki sifat basa lemah, etos kerja dalam islam juga menekankan pada keseimbangan antara aspek spiritual dan praktis, sehingga menghasilkan perilaku kerja yang berlandaskan nilai-nilai luhur.
Ringkasan Akhir

Garam dari asam lemah dan basa lemah merupakan aspek penting dalam kimia, dengan sifat dan aplikasinya yang luas. Memahami garam-garam ini sangat penting untuk berbagai bidang, termasuk kimia analitik, kimia medis, dan ilmu lingkungan.
Area Tanya Jawab
Apa itu garam dari asam lemah dan basa lemah?
Garam yang dihasilkan dari reaksi antara asam lemah dan basa lemah.
Apa sifat khas garam dari asam lemah dan basa lemah?
Mereka cenderung bersifat netral atau sedikit asam, dan dapat menghidrolisis dalam air.
Apa saja contoh umum garam dari asam lemah dan basa lemah?
Asetat natrium, bikarbonat natrium, dan amonium klorida.
Apa saja aplikasi garam dari asam lemah dan basa lemah?
Dalam obat-obatan, industri makanan, dan sebagai penyangga dalam sistem biologis.
