Contoh perubahan entalpi pembentukan standar – Dalam kimia, memahami perubahan entalpi pembentukan standar sangat penting untuk memprediksi dan mengendalikan reaksi kimia. Perubahan entalpi ini mengungkapkan jumlah energi yang diserap atau dilepaskan selama pembentukan satu mol senyawa dari unsur-unsurnya dalam keadaan standar.
Konsep ini menjadi landasan untuk memahami perubahan energi dalam reaksi kimia, memungkinkan para ilmuwan memprediksi hasil dan mengoptimalkan proses industri.
Pengertian Entalpi Pembentukan Standar
Entalpi pembentukan standar (ΔH f°) adalah perubahan entalpi yang menyertai pembentukan satu mol suatu senyawa dari unsur-unsur penyusunnya dalam keadaan standar (1 atm dan 25 °C). Ini merupakan ukuran stabilitas suatu senyawa, di mana nilai negatif menunjukkan bahwa senyawa tersebut stabil dan nilai positif menunjukkan bahwa senyawa tersebut tidak stabil.
Pentingnya Entalpi Pembentukan Standar
- Memprediksi arah reaksi kimia.
- Menghitung perubahan entalpi reaksi.
- Membandingkan stabilitas senyawa yang berbeda.
- Merancang proses kimia baru.
Contoh Reaksi Kimia
Sebagai contoh, reaksi pembentukan metana (CH 4) dari unsur-unsurnya adalah:
C (grafit) + 4 H2(g) → CH 4(g)ΔH f° =
74,8 kJ/mol
Nilai negatif ΔH f° menunjukkan bahwa metana adalah senyawa yang stabil.
Faktor yang Mempengaruhi Entalpi Pembentukan Standar

Entalpi pembentukan standar suatu zat merupakan perubahan entalpi yang terjadi ketika satu mol zat tersebut terbentuk dari unsur-unsurnya dalam keadaan standar. Faktor-faktor tertentu dapat mempengaruhi nilai entalpi pembentukan standar, antara lain:
Jenis Ikatan Kimia
Jenis ikatan kimia yang terbentuk antara unsur-unsur penyusun suatu zat mempengaruhi entalpi pembentukan standar. Ikatan yang lebih kuat biasanya menghasilkan entalpi pembentukan standar yang lebih negatif, menunjukkan pelepasan panas yang lebih besar selama pembentukan ikatan.
Jumlah Ikatan
Jumlah ikatan kimia dalam suatu molekul juga mempengaruhi entalpi pembentukan standar. Semakin banyak ikatan yang terbentuk, semakin besar entalpi pembentukan standar negatif, karena lebih banyak energi yang dilepaskan selama pembentukan ikatan.
Geometri Molekul
Geometri molekul mempengaruhi entalpi pembentukan standar karena mempengaruhi panjang dan kekuatan ikatan. Geometri yang lebih kompak, seperti geometri tetrahedral, umumnya menghasilkan entalpi pembentukan standar yang lebih negatif dibandingkan dengan geometri yang lebih longgar, seperti geometri oktahedral.
Aplikasi Entalpi Pembentukan Standar
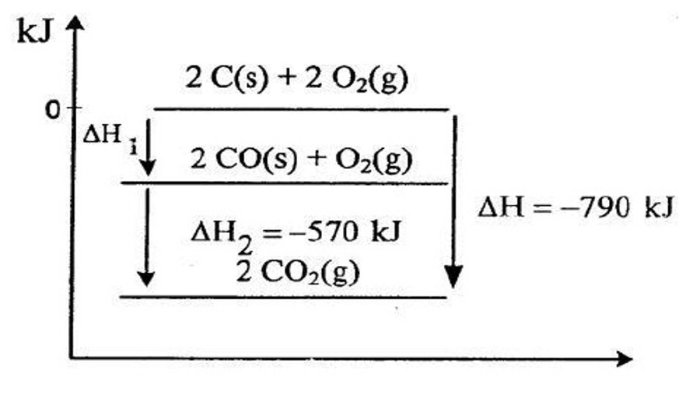
Entalpi pembentukan standar adalah perubahan entalpi yang menyertai pembentukan 1 mol suatu senyawa dari unsur-unsurnya dalam keadaan standar (298 K dan 1 atm).
Nilai entalpi pembentukan standar dapat digunakan untuk memprediksi perubahan entalpi reaksi kimia. Perubahan entalpi reaksi adalah perubahan entalpi yang menyertai reaksi kimia.
Contoh perubahan entalpi pembentukan standar meliputi reaksi pembakaran metana, yang melepaskan energi 890,3 kJ/mol. Di sisi lain, peristiwa sejarah yang penting, seperti saat Yesus memikul salib ke Golgota, disebutkan dalam kitab-kitab Injil bahwa Ia jatuh sebanyak tiga kali . Kembali ke topik kimia, perubahan entalpi pembentukan standar juga berperan penting dalam perhitungan energi reaksi dan prediksi arah reaksi kimia.
Cara Menggunakan Entalpi Pembentukan Standar untuk Memprediksi Perubahan Entalpi Reaksi
Perubahan entalpi reaksi dapat dihitung menggunakan persamaan berikut:
ΔH°rxn= ΣnΔH° f(produk)
ΣmΔH°f(reaktan)
di mana:
- ΔH° rxnadalah perubahan entalpi reaksi
- ΔH° fadalah entalpi pembentukan standar
- n dan m adalah koefisien stoikiometri produk dan reaktan
Sebagai contoh, pertimbangkan reaksi pembakaran metana berikut:
CH4(g) + 2O 2(g) → CO 2(g) + 2H 2O(g)
Entalpi pembentukan standar untuk setiap senyawa adalah:
- CH 4(g): -74,8 kJ/mol
- O 2(g): 0 kJ/mol
- CO 2(g): -393,5 kJ/mol
- H 2O(g): -241,8 kJ/mol
Menggunakan persamaan di atas, perubahan entalpi reaksi dapat dihitung sebagai berikut:
ΔH°rxn= [(-393,5 kJ/mol) + (-241,8 kJ/mol)
- 2]
- [(-74,8 kJ/mol) + (0 kJ/mol)
- 2]
ΔH°rxn=
802,3 kJ/mol
Contoh perubahan entalpi pembentukan standar dapat diamati pada reaksi pembentukan metana dari unsur-unsurnya. Rumus untuk menentukan apakah nilai yang dihasilkan memenuhi syarat atau tidak dalam Microsoft Excel, seperti yang dijelaskan pada rumus keterangan lulus atau tidak di excel , dapat diterapkan untuk mengevaluasi apakah perubahan entalpi pembentukan standar memenuhi nilai yang diharapkan atau tidak.
Dengan menggunakan rumus ini, peneliti dapat dengan cepat dan akurat menentukan apakah hasil eksperimen mereka valid dan konsisten dengan data yang ada.
Nilai negatif dari ΔH° rxnmenunjukkan bahwa reaksi ini eksotermik, artinya reaksi ini melepaskan panas.
Cara Menentukan Entalpi Pembentukan Standar

Entalpi pembentukan standar adalah perubahan entalpi yang menyertai pembentukan satu mol senyawa dari unsur-unsurnya dalam keadaan standar. Pengukuran entalpi pembentukan standar penting untuk memahami stabilitas dan reaktivitas senyawa.
Kalorimetri, Contoh perubahan entalpi pembentukan standar
Kalorimetri adalah metode eksperimental umum untuk menentukan entalpi pembentukan standar. Kalorimeter adalah alat yang mengukur panas yang diserap atau dilepaskan selama reaksi kimia. Reaksi yang dipelajari dilakukan dalam kalorimeter, dan perubahan suhu dicatat. Dengan mengetahui kapasitas panas kalorimeter dan perubahan suhu, entalpi reaksi dapat dihitung.
Teknik Komputasi
Selain metode eksperimental, teknik komputasi juga dapat digunakan untuk memperkirakan entalpi pembentukan standar. Metode ini menggunakan perhitungan mekanika kuantum untuk menghitung energi elektron dan nuklei dalam senyawa. Metode ini dapat memberikan perkiraan entalpi pembentukan standar yang akurat, terutama untuk senyawa yang sulit dipelajari secara eksperimental.
Tabel Entalpi Pembentukan Standar

Entalpi pembentukan standar (ΔH°f) adalah perubahan entalpi yang menyertai pembentukan 1 mol senyawa dari unsur-unsurnya dalam keadaan standar (298 K, 1 atm).
Tabel entalpi pembentukan standar memberikan nilai ΔH°f untuk senyawa umum, seperti air, metana, dan karbon dioksida. Tabel ini sangat berguna untuk memprediksi perubahan entalpi reaksi kimia.
Menggunakan Tabel Entalpi Pembentukan Standar
- Untuk reaksi kimia:
- a 1A 1+ a 2A 2+ … → b 1B 1+ b 2B 2+ …
- Perubahan entalpi standar (ΔH°rxn) dapat dihitung menggunakan persamaan berikut:
- ΔH°rxn = ∑[b iΔH°f(B i)] – ∑[a iΔH°f(A i)]
- di mana:
- ΔH°f(B i) adalah entalpi pembentukan standar produk
- ΔH°f(A i) adalah entalpi pembentukan standar reaktan
- a idan b iadalah koefisien stoikiometri reaktan dan produk
Contoh
Hitung ΔH°rxn untuk reaksi berikut:
- CH 4(g) + 2O 2(g) → CO 2(g) + 2H 2O(g)
Menggunakan tabel entalpi pembentukan standar, kita memperoleh:
- ΔH°f(CH 4) = -74,8 kJ/mol
- ΔH°f(O 2) = 0 kJ/mol
- ΔH°f(CO 2) = -393,5 kJ/mol
- ΔH°f(H 2O) = -285,8 kJ/mol
Menghitung ΔH°rxn:
- ΔH°rxn = [(-393,5 kJ/mol) + (-285,8 kJ/mol)] – [(-74,8 kJ/mol) + (0 kJ/mol)]
- ΔH°rxn = -890,1 kJ/mol
Nilai negatif ΔH°rxn menunjukkan bahwa reaksi ini bersifat eksotermik, artinya reaksi ini melepaskan panas.
Contoh Penggunaan Entalpi Pembentukan Standar

Entalpi pembentukan standar telah digunakan secara luas dalam penelitian dan aplikasi praktis untuk memahami reaksi kimia dan merancang proses industri.
Aplikasi dalam Perhitungan Perubahan Entalpi Reaksi
Entalpi pembentukan standar memungkinkan perhitungan perubahan entalpi reaksi dengan menggunakan rumus:
ΔH° reaksi= ΣΔH° pembentukan(produk) – ΣΔH° pembentukan(reaktan)
Contoh perubahan entalpi pembentukan standar, seperti pembakaran metana (CH 4), melibatkan pelepasan sejumlah besar panas. Proses ini dapat dianalogikan dengan konsep “bermain sambil memuliakan Tuhan” ( apa artinya bermain sambil memuliakan tuhan ). Dalam konteks musik Kristen, bermain musik dengan tujuan untuk memuliakan Tuhan memberikan sukacita dan kepuasan spiritual.
Demikian pula, perubahan entalpi pembentukan standar yang melepaskan panas menciptakan rasa pencapaian ilmiah dan pemahaman yang lebih dalam tentang sifat materi.
Dengan menggunakan rumus ini, perubahan entalpi reaksi dapat diprediksi berdasarkan entalpi pembentukan standar dari reaktan dan produk.
Aplikasi dalam Pemilihan Bahan Bakar
Entalpi pembentukan standar digunakan untuk memilih bahan bakar yang optimal. Bahan bakar dengan entalpi pembentukan standar yang lebih rendah memiliki nilai kalor yang lebih tinggi dan melepaskan lebih banyak energi saat dibakar.
Aplikasi dalam Rancang Proses Industri
Entalpi pembentukan standar digunakan dalam perancangan proses industri untuk mengoptimalkan efisiensi energi dan meminimalkan biaya produksi. Misalnya, dalam industri semen, entalpi pembentukan standar digunakan untuk menentukan suhu dan kondisi pembakaran yang optimal untuk memproduksi klinker semen.
Ulasan Penutup

Dengan memahami contoh perubahan entalpi pembentukan standar, para kimiawan dapat mengungkap misteri transformasi energi dalam reaksi kimia. Pengetahuan ini memberdayakan mereka untuk merancang bahan baru, mengoptimalkan proses industri, dan memajukan pemahaman kita tentang dunia alam.
Kumpulan Pertanyaan Umum: Contoh Perubahan Entalpi Pembentukan Standar
Apa itu perubahan entalpi pembentukan standar?
Perubahan entalpi pembentukan standar adalah jumlah energi yang diserap atau dilepaskan ketika satu mol senyawa terbentuk dari unsur-unsurnya dalam keadaan standar.
Bagaimana faktor-faktor seperti ikatan kimia memengaruhi entalpi pembentukan standar?
Jenis dan jumlah ikatan kimia dalam suatu senyawa dapat secara signifikan memengaruhi entalpi pembentukan standarnya. Misalnya, ikatan kovalen yang lebih kuat umumnya menghasilkan entalpi pembentukan yang lebih negatif.
