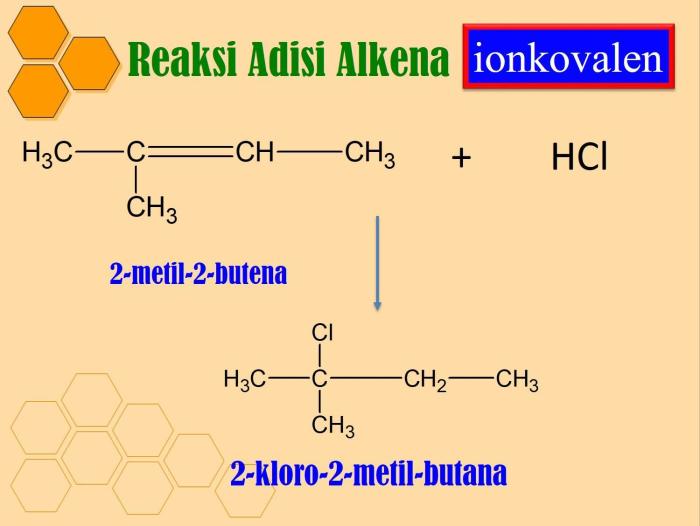
Reaksi bolak balik, juga dikenal sebagai reaksi reversibel, adalah fenomena menarik dalam kimia yang melibatkan transformasi dua atau lebih zat dalam dua arah yang berlawanan. Dalam reaksi ini, produk yang terbentuk dapat bereaksi kembali untuk menghasilkan reaktan awal, menghasilkan kesetimbangan dinamis.
Reaksi bolak balik berperan penting dalam berbagai proses alam dan industri, termasuk metabolisme seluler, sintesis kimia, dan keseimbangan ekosistem. Memahami sifat dan aplikasi reaksi ini sangat penting untuk memajukan ilmu pengetahuan dan teknologi.
Definisi Reaksi Bolak Balik
Reaksi bolak balik adalah reaksi kimia di mana reaktan bereaksi untuk membentuk produk, dan produk tersebut dapat bereaksi kembali untuk membentuk reaktan awal. Reaksi ini terus berlangsung sampai kesetimbangan tercapai.
Reaksi bolak balik biasanya dilambangkan dengan tanda panah dua arah (↔). Misalnya, reaksi berikut adalah reaksi bolak balik:
A + B ↔ C
Reaksi ini menunjukkan bahwa reaktan A dan B bereaksi untuk membentuk produk C, dan C dapat bereaksi kembali untuk membentuk A dan B.
Contoh Reaksi Bolak Balik
- Reaksi Haber: N2 + 3H2 ↔ 2NH3
- Reaksi pembentukan hidrogen iodium: H2 + I2 ↔ 2HI
- Reaksi esterifikasi Fischer: Alkohol + Asam karboksilat ↔ Ester + Air
Karakteristik Reaksi Bolak Balik

Reaksi bolak balik adalah reaksi kimia di mana reaktan dan produk saling berinteraksi secara terus-menerus, menghasilkan kesetimbangan dinamis. Karakteristik unik dari reaksi ini mencakup:
Konsep Kesetimbangan Kimia
Kesetimbangan kimia adalah keadaan di mana laju reaksi maju sama dengan laju reaksi balik. Pada kesetimbangan, konsentrasi reaktan dan produk tetap konstan dari waktu ke waktu.
Contoh Kesetimbangan dalam Reaksi Bolak Balik
Salah satu contoh reaksi bolak balik yang umum adalah reaksi antara gas nitrogen dioksida (NO 2 ) dan dinitrogen tetroksida (N 2 O 4 ):
NO 2 (g) ⇌ N 2 O 4 (g)
Pada kesetimbangan, campuran gas akan mengandung NO 2 dan N 2 O 4 dalam konsentrasi tetap.
Faktor yang Mempengaruhi Reaksi Bolak Balik
Reaksi bolak balik dipengaruhi oleh berbagai faktor yang dapat memengaruhi laju dan arah reaksi. Memahami faktor-faktor ini sangat penting untuk mengontrol dan mengoptimalkan reaksi kimia.
Konsentrasi Reaktan
Konsentrasi reaktan berbanding lurus dengan laju reaksi. Semakin tinggi konsentrasi reaktan, semakin banyak molekul yang tersedia untuk bereaksi, sehingga meningkatkan laju reaksi.
Suhu
Suhu juga memengaruhi laju reaksi. Semakin tinggi suhu, semakin cepat molekul bergerak dan semakin sering mereka bertumbukan. Hal ini meningkatkan laju reaksi.
Luas Permukaan
Luas permukaan reaktan dapat memengaruhi laju reaksi. Semakin besar luas permukaan, semakin banyak situs aktif yang tersedia untuk bereaksi, sehingga meningkatkan laju reaksi.
Katalis
Katalis adalah zat yang mempercepat reaksi kimia tanpa dikonsumsi. Katalis menyediakan jalur alternatif untuk reaksi yang membutuhkan energi aktivasi lebih rendah, sehingga meningkatkan laju reaksi.
Penghambat
Penghambat adalah zat yang memperlambat reaksi kimia. Penghambat berinteraksi dengan reaktan atau katalis, menghalangi reaksi dan mengurangi laju reaksi.
Tekanan
Tekanan hanya memengaruhi reaksi bolak balik yang melibatkan gas. Peningkatan tekanan akan menggeser kesetimbangan ke arah sisi dengan volume gas yang lebih kecil.
Imbangan Kimia
Imbangan kimia adalah keadaan ketika laju reaksi maju dan mundur sama. Faktor-faktor seperti konsentrasi reaktan, suhu, dan katalis dapat memengaruhi posisi kesetimbangan, menggesernya ke arah reaktan atau produk.
Aplikasi Reaksi Bolak Balik

Reaksi bolak balik memainkan peran penting dalam berbagai aspek kehidupan kita, industri, dan penelitian.
Contoh dalam Kehidupan Sehari-hari
*
-*Fotosintesis
Tumbuhan menggunakan reaksi bolak balik untuk mengubah karbon dioksida dan air menjadi glukosa dan oksigen.
-
-*Respirasi Seluler
Sel menggunakan reaksi bolak balik untuk menghasilkan energi dari glukosa.
-*Pencernaan
Enzim dalam sistem pencernaan kita menggunakan reaksi bolak balik untuk memecah makanan menjadi nutrisi yang lebih kecil.
Peran dalam Industri dan Penelitian
*
-*Industri Kimia
Reaksi bolak balik digunakan untuk memproduksi berbagai bahan kimia, seperti amonia, asam sulfat, dan metanol.
-
-*Industri Farmasi
Reaksi bolak balik digunakan untuk mensintesis obat-obatan dan bahan farmasi lainnya.
-*Penelitian Ilmiah
Reaksi bolak balik digunakan untuk mempelajari sifat kesetimbangan kimia dan untuk mengembangkan metode baru untuk sintesis kimia.
Percobaan untuk Mendemonstrasikan Reaksi Bolak Balik
Bahan:* Gelas beaker
- Larutan amonium klorida
- Larutan natrium hidroksida
- Kertas lakmus merah dan biru
Prosedur:
- Tuangkan larutan amonium klorida dan natrium hidroksida ke dalam gelas beaker terpisah.
- Celupkan kertas lakmus merah ke dalam larutan amonium klorida dan kertas lakmus biru ke dalam larutan natrium hidroksida.
- Campurkan kedua larutan.
- Amati perubahan warna kertas lakmus.
Hasil:Kertas lakmus merah akan berubah menjadi biru, dan kertas lakmus biru akan berubah menjadi merah. Hal ini menunjukkan bahwa reaksi bolak balik telah terjadi, membentuk amonia dan air.
Contoh Reaksi Bolak Balik

Reaksi bolak balik merupakan reaksi kimia yang dapat berlangsung dalam dua arah, artinya reaktan dan produk dapat saling berkonversi. Reaksi ini memainkan peran penting dalam banyak sistem biologis dan lingkungan.
Daftar Reaksi Bolak Balik Umum
- Reaksi Haber: N2(g) + 3H2(g) ⇌ 2NH3(g)
- Reaksi Boudouard: CO2(g) + C(s) ⇌ 2CO(g)
- Reaksi Le Chatelier: CaCO3(s) ⇌ CaO(s) + CO2(g)
- Reaksi Esterifikasi: Alkohol + Asam Karboksilat ⇌ Ester + Air
- Reaksi Hidrolisis: Ester + Air ⇌ Alkohol + Asam Karboksilat
Mekanisme Reaksi Bolak Balik
Mekanisme reaksi bolak balik biasanya melibatkan pembentukan senyawa antara yang tidak stabil. Senyawa antara ini dapat terurai menjadi reaktan asli atau membentuk produk baru. Reaksi Haber, misalnya, terjadi melalui pembentukan senyawa antara NH2 yang tidak stabil.
Implikasi Reaksi Bolak Balik
Reaksi bolak balik memiliki implikasi penting pada sistem biologis dan lingkungan. Dalam sistem biologis, reaksi bolak balik berperan dalam mengatur keseimbangan kimiawi dan mempertahankan homeostasis. Dalam lingkungan, reaksi bolak balik terlibat dalam siklus biogeokimia dan pengaturan komposisi atmosfer.
Simpulan Akhir
Reaksi bolak balik merupakan proses fundamental dalam kimia yang memungkinkan terjadinya kesetimbangan dan memainkan peran penting dalam banyak aspek kehidupan. Pemahaman mendalam tentang reaksi ini sangat penting untuk berbagai bidang, mulai dari biologi hingga industri, dan penelitian berkelanjutan terus mengungkap aplikasi dan implikasi baru dari reaksi bolak balik.
Ringkasan FAQ
Apa saja ciri-ciri reaksi bolak balik?
Reaksi bolak balik ditandai dengan kesetimbangan dinamis, di mana laju reaksi maju dan mundur sama, menghasilkan konsentrasi konstan reaktan dan produk.
Apa saja faktor yang mempengaruhi arah reaksi bolak balik?
Arah reaksi bolak balik dipengaruhi oleh konsentrasi reaktan dan produk, suhu, tekanan, dan katalis.
Berikan contoh reaksi bolak balik dalam kehidupan sehari-hari.
Fotosintesis dan respirasi seluler adalah contoh reaksi bolak balik yang terjadi di dalam tubuh organisme hidup.