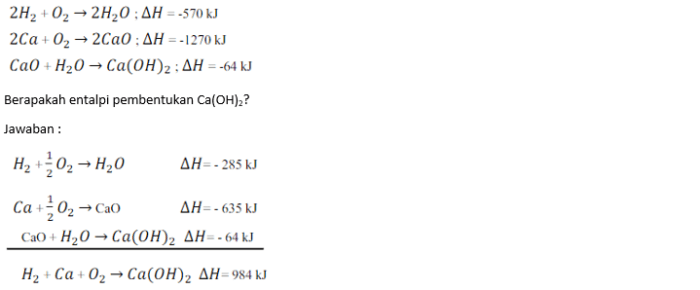Entalpi pembentukan standar merupakan besaran penting dalam termodinamika kimia, memberikan wawasan tentang perubahan energi yang menyertai pembentukan senyawa dari unsur-unsurnya.
Dalam artikel ini, kita akan membahas konsep entalpi pembentukan standar, metode untuk menghitungnya, faktor-faktor yang mempengaruhinya, dan contoh soal langkah demi langkah untuk menguasai perhitungan ini.
Pengertian Entalpi Pembentukan Standar

Entalpi pembentukan standar adalah perubahan entalpi yang terjadi ketika satu mol suatu senyawa terbentuk dari unsur-unsurnya dalam keadaan standar (1 atm dan 298 K).
Reaksi pembentukan standar adalah reaksi kimia yang menghasilkan satu mol senyawa dari unsur-unsurnya dalam keadaan standar. Misalnya, reaksi pembentukan standar air adalah:
Reaksi Pembentukan Standar Air
H 2 (g) + ½ O 2 (g) → H 2 O(l)
Cara Menghitung Entalpi Pembentukan Standar
Entalpi pembentukan standar adalah perubahan entalpi yang menyertai pembentukan satu mol senyawa dari unsur-unsurnya dalam keadaan standar (298 K dan 1 atm). Perhitungan entalpi pembentukan standar dapat dilakukan menggunakan metode Hess.
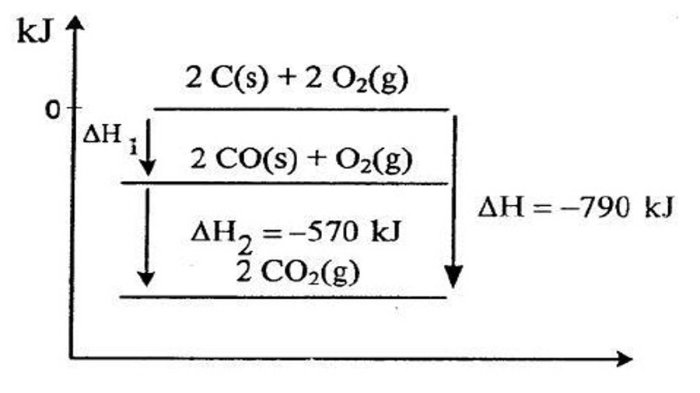
Metode Hess
Metode Hess menyatakan bahwa perubahan entalpi reaksi adalah sama, terlepas dari jalur reaksi yang diambil. Langkah-langkah menghitung entalpi pembentukan standar menggunakan metode Hess adalah sebagai berikut:
- Tulis persamaan reaksi pembentukan senyawa dari unsur-unsurnya.
- Pecah reaksi pembentukan menjadi serangkaian reaksi bertingkat yang diketahui entalpinya.
- Kalikan setiap reaksi bertingkat dengan koefisien yang sesuai untuk menyeimbangkan persamaan reaksi keseluruhan.
- Jumlahkan entalpi reaksi bertingkat untuk mendapatkan entalpi pembentukan standar senyawa.
Faktor yang Mempengaruhi Entalpi Pembentukan Standar

Entalpi pembentukan standar suatu senyawa dipengaruhi oleh beberapa faktor, antara lain:
Ikatan Kimia
Ikatan kimia yang terbentuk dalam suatu senyawa mempengaruhi entalpi pembentukannya. Semakin kuat ikatan yang terbentuk, semakin negatif entalpi pembentukannya. Hal ini karena pembentukan ikatan yang kuat melepaskan energi.
Ukuran Atom dan Ion
Ukuran atom dan ion yang terlibat dalam pembentukan senyawa juga mempengaruhi entalpi pembentukan. Semakin besar ukuran atom atau ion, semakin positif entalpi pembentukannya. Hal ini karena atom atau ion yang lebih besar memiliki elektron yang lebih terdelokalisasi, sehingga membutuhkan lebih banyak energi untuk membentuk ikatan.
Elektronegativitas
Elektronegativitas unsur-unsur yang terlibat dalam pembentukan senyawa juga mempengaruhi entalpi pembentukan. Semakin besar perbedaan elektronegativitas antara unsur-unsur, semakin positif entalpi pembentukannya. Hal ini karena perbedaan elektronegativitas yang besar menyebabkan polarisasi ikatan dan pembentukan muatan parsial, yang membutuhkan energi.
Keadaan Fisika
Keadaan fisika senyawa juga mempengaruhi entalpi pembentukannya. Umumnya, entalpi pembentukan senyawa dalam keadaan gas lebih positif daripada dalam keadaan cair atau padat. Hal ini karena perubahan keadaan dari gas ke cair atau padat melepaskan energi.
Aplikasi Entalpi Pembentukan Standar
Entalpi pembentukan standar adalah ukuran perubahan entalpi yang terjadi ketika satu mol suatu senyawa terbentuk dari unsur-unsur penyusunnya dalam keadaan standar. Aplikasi entalpi pembentukan standar meliputi:
Contoh Aplikasi
- Prediksi entalpi reaksi: Dengan menggunakan entalpi pembentukan standar reaktan dan produk, kita dapat menghitung entalpi reaksi menggunakan persamaan:
ΔH reaksi = ΣΔH pembentukan produk
– ΣΔH pembentukan reaktan - Penentuan kespontanan reaksi: Reaksi spontan memiliki ΔH reaksi negatif, menunjukkan bahwa reaksi melepaskan panas ke lingkungan.
- Perhitungan kalor pembakaran: Entalpi pembentukan standar dapat digunakan untuk menghitung kalor pembakaran senyawa dengan menggunakan persamaan:
ΔH pembakaran =
-ΔH pembentukan produk (CO2, H2O)
Contoh Soal Entalpi Pembentukan Standar

Entalpi pembentukan standar adalah perubahan entalpi yang terjadi ketika satu mol suatu senyawa terbentuk dari unsur-unsurnya dalam keadaan standar (25°C, 1 atm).
Berikut adalah contoh soal yang mengharuskan perhitungan entalpi pembentukan standar:
Petunjuk Penyelesaian
- Tuliskan persamaan reaksi pembentukan senyawa yang diinginkan.
- Tentukan entalpi pembentukan standar (ΔHf0) untuk setiap senyawa yang terlibat dalam reaksi.
- Gunakan persamaan reaksi untuk menentukan koefisien stoikiometri senyawa yang bereaksi dan terbentuk.
- Kalikan ΔHf0 setiap senyawa dengan koefisien stoikiometinya.
- Jumlahkan nilai-nilai yang diperoleh untuk menghitung entalpi pembentukan standar reaksi.
Contoh Soal
Hitunglah entalpi pembentukan standar untuk metana (CH 4 ) menggunakan data berikut:
| Senyawa | ΔH f 0 (kJ/mol) ||—|—|| C(s, grafit) | 0 || H 2 (g) | 0 || CH 4 (g) |
74,8 |
Persamaan reaksi pembentukan metana:
“`C(s, grafit) + 2H 2 (g) → CH 4 (g)“`
Dengan menggandakan ΔH f 0 setiap senyawa dengan koefisien stoikiometinya dan menjumlahkannya, kita memperoleh entalpi pembentukan standar reaksi:
“`ΔH f 0 = 0 + 2(0)
- (-74,8) =
- 74,8 kJ/mol
“`
Jadi, entalpi pembentukan standar metana adalah -74,8 kJ/mol.
Terakhir
Memahami entalpi pembentukan standar sangat penting untuk memprediksi reaksi kimia dan merancang proses kimia yang efisien. Dengan menguasai konsep dan teknik perhitungan ini, ahli kimia dapat memperoleh pemahaman mendalam tentang perubahan energi yang mendorong reaksi kimia.
Pertanyaan dan Jawaban
Apa itu entalpi pembentukan standar?
Entalpi pembentukan standar adalah perubahan entalpi ketika satu mol senyawa terbentuk dari unsur-unsurnya dalam keadaan standar (298 K, 1 atm).
Bagaimana cara menghitung entalpi pembentukan standar?
Entalpi pembentukan standar dapat dihitung menggunakan metode Hess, yang melibatkan penjumlahan entalpi reaksi standar untuk reaksi yang mengarah pada pembentukan senyawa yang diinginkan.
Faktor apa saja yang mempengaruhi entalpi pembentukan standar?
Faktor-faktor yang mempengaruhi entalpi pembentukan standar meliputi ikatan kimia, struktur molekul, dan keadaan fisik unsur-unsur penyusun.