Hukum 1 termodinamika merupakan prinsip fundamental yang mengatur transfer dan transformasi energi dalam sistem termodinamika. Konsep ini sangat penting dalam berbagai bidang ilmu pengetahuan dan teknik, termasuk fisika, kimia, dan teknik mesin.
Artikel ini akan memberikan gambaran umum tentang hukum 1 termodinamika, persamaan matematikanya, penerapannya dalam berbagai sistem termodinamika, dan contoh soal yang dapat membantu pembaca memahami konsep ini secara mendalam.
Pengertian Hukum 1 Termodinamika
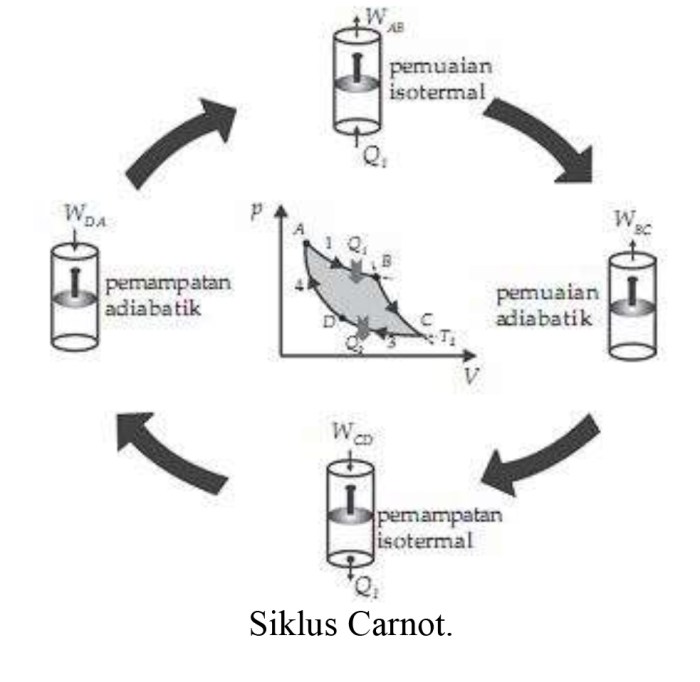
Hukum 1 termodinamika, juga dikenal sebagai hukum kekekalan energi, menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah dari satu bentuk ke bentuk lainnya.
Energi dapat berupa berbagai bentuk, seperti energi kinetik, energi potensial, energi panas, dan energi kimia. Hukum 1 termodinamika menyiratkan bahwa jumlah total energi dalam sistem tertutup tetap konstan, meskipun energi tersebut dapat berubah bentuk.
Contoh Penerapan Hukum 1 Termodinamika
- Ketika kita membakar kayu, energi kimia dalam kayu diubah menjadi energi panas dan cahaya.
- Ketika kita mengendarai mobil, energi kimia dalam bahan bakar diubah menjadi energi kinetik mobil.
- Ketika kita menggunakan panel surya, energi cahaya matahari diubah menjadi energi listrik.
Persamaan Matematika Hukum 1 Termodinamika
Hukum 1 termodinamika dapat dinyatakan dalam bentuk persamaan matematika sebagai berikut:
ΔU = Q – W
Di mana:
- ΔU adalah perubahan energi internal sistem
- Q adalah panas yang ditambahkan ke sistem
- W adalah kerja yang dilakukan oleh sistem
Persamaan ini menyatakan bahwa perubahan energi internal suatu sistem sama dengan selisih antara panas yang ditambahkan ke sistem dan kerja yang dilakukan oleh sistem.
Penerapan Hukum 1 Termodinamika dalam Sistem Termodinamika
Hukum 1 termodinamika menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah dari satu bentuk ke bentuk lainnya. Hukum ini berlaku untuk semua sistem termodinamika, yaitu sistem yang dapat dipertukarkan energi dan materi dengan lingkungannya.
Jenis-Jenis Sistem Termodinamika
Sistem termodinamika dapat diklasifikasikan menjadi tiga jenis:
- Sistem Tertutup: Sistem yang tidak dapat bertukar energi atau materi dengan lingkungannya.
- Sistem Terbuka: Sistem yang dapat bertukar energi dan materi dengan lingkungannya.
- Sistem Terisolasi: Sistem yang tidak dapat bertukar energi atau materi dengan lingkungannya.
Hukum 1 Termodinamika pada Sistem Tertutup
Pada sistem tertutup, energi total sistem tetap konstan. Energi yang masuk ke sistem akan digunakan untuk meningkatkan energi dalam sistem, yang dapat berupa energi kinetik, potensial, atau internal.
Hukum 1 Termodinamika pada Sistem Terbuka
Pada sistem terbuka, energi total sistem dapat berubah karena adanya pertukaran energi dan materi dengan lingkungannya. Energi yang masuk ke sistem akan digunakan untuk meningkatkan energi dalam sistem atau melakukan usaha terhadap lingkungan.
Hukum 1 Termodinamika pada Sistem Terisolasi
Pada sistem terisolasi, energi total sistem tetap konstan karena tidak ada pertukaran energi atau materi dengan lingkungannya. Energi dalam sistem hanya dapat diubah dari satu bentuk ke bentuk lainnya.
Contoh Sistem Termodinamika dan Aplikasinya
Beberapa contoh sistem termodinamika yang nyata dan aplikasinya meliputi:
- Mesin Panas: Sistem terbuka yang mengubah energi panas menjadi usaha mekanik. Contoh: mesin mobil.
- Kulkas: Sistem tertutup yang memindahkan panas dari bagian dalam ke bagian luar. Contoh: lemari es.
- Proses Biologi: Sistem terbuka yang melibatkan pertukaran energi dan materi dalam makhluk hidup. Contoh: metabolisme.
Contoh Soal dan Pembahasan Hukum 1 Termodinamika
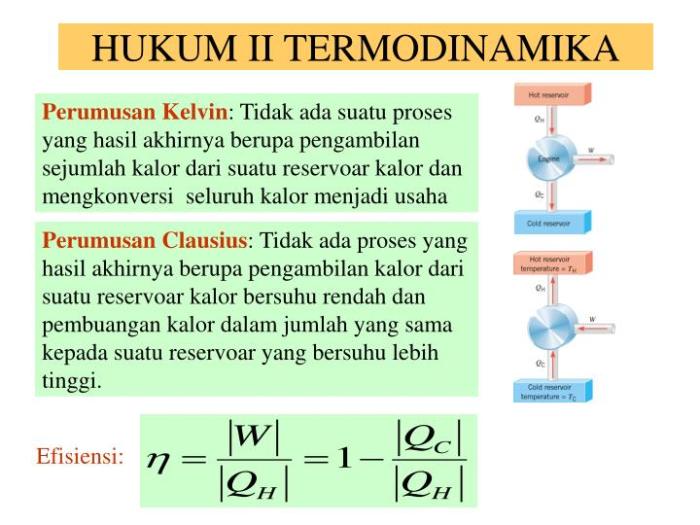
Hukum 1 termodinamika menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah bentuknya. Hukum ini juga dikenal sebagai hukum kekekalan energi. Berikut adalah beberapa contoh soal yang melibatkan hukum 1 termodinamika:
Contoh Soal 1
Sebuah mesin menerima 1000 joule energi panas dari reservoir panas dan melakukan usaha sebesar 600 joule. Berapakah perubahan energi dalam mesin tersebut? Langkah Penyelesaian: * Hukum 1 termodinamika menyatakan bahwa:“`ΔU = Q
W
“`di mana:
- ΔU adalah perubahan energi dalam
- Q adalah panas yang diterima
- W adalah usaha yang dilakukan
* Substitusikan nilai yang diberikan ke dalam persamaan:“`ΔU = 1000 J
600 J = 400 J
“` Pembahasan: Perubahan energi dalam mesin adalah 400 joule. Energi ini disimpan sebagai energi internal, seperti energi kinetik dan potensial molekul-molekul dalam mesin.
Contoh Soal 2
Sebuah sistem menerima 200 kalori panas dari lingkungan dan melakukan usaha sebesar 150 kalori. Berapakah perubahan entalpi sistem tersebut? Langkah Penyelesaian: * Perubahan entalpi (ΔH) dapat dihitung menggunakan persamaan:“`ΔH = ΔU + PΔV“`di mana:
- P adalah tekanan
- V adalah volume
* Karena tekanan dan volume tidak disebutkan dalam soal, kita asumsikan bahwa prosesnya berlangsung pada tekanan dan volume konstan. Dalam hal ini, persamaan di atas menjadi:“`ΔH = ΔU“`* Kita sudah menghitung ΔU pada contoh soal 1, yaitu 400 joule. Karena 1 kalori sama dengan 4,184 joule, maka:“`ΔH = 400 J / 4,184 J/kal = 95,6 kal“` Pembahasan: Perubahan entalpi sistem adalah 95,6 kalori.
Energi ini dapat digunakan untuk melakukan kerja atau diubah menjadi bentuk energi lainnya.
Tips dan Trik untuk Menyelesaikan Soal Hukum 1 Termodinamika
* Pahami konsep energi dan bentuk-bentuknya.
Ingat persamaan hukum 1 termodinamika
ΔU = Q
- W.
- Perhatikan satuan yang digunakan dan konversikan jika perlu.
- Gambarlah diagram sistem untuk memvisualisasikan aliran energi.
- Berlatihlah mengerjakan berbagai jenis soal untuk meningkatkan pemahaman.
Kesalahan Umum dalam Penerapan Hukum 1 Termodinamika

Penerapan hukum 1 termodinamika sering kali menimbulkan kesalahan. Kesalahan ini dapat berdampak signifikan pada akurasi dan keandalan analisis termodinamika.
Memperlakukan Sistem Tertutup sebagai Terbuka
Kesalahan umum adalah memperlakukan sistem tertutup sebagai sistem terbuka. Dalam sistem tertutup, tidak ada pertukaran massa atau energi dengan lingkungan. Sebaliknya, sistem terbuka memungkinkan pertukaran massa dan energi.Contoh:
- Menganalisis mesin pembakaran sebagai sistem terbuka ketika katup masuk dan keluar tertutup.
- Menganalisis reaktor kimia sebagai sistem tertutup ketika gas bereaksi bocor ke lingkungan.
Mengabaikan Perubahan Energi Potensial
Kesalahan umum lainnya adalah mengabaikan perubahan energi potensial. Energi potensial adalah energi yang terkait dengan posisi atau ketinggian suatu sistem.Contoh:
- Menganalisis fluida yang mengalir melalui pipa tanpa memperhitungkan perubahan energi potensial karena perubahan ketinggian.
- Menganalisis pesawat terbang tanpa memperhitungkan perubahan energi potensial karena perubahan ketinggian.
Menggunakan Kapasitas Panas Konstan untuk Proses Volume Konstan
Kapasitas panas konstan adalah kapasitas panas suatu sistem pada volume konstan. Namun, untuk proses volume konstan, kapasitas panas yang tepat untuk digunakan adalah kapasitas panas isokhorik.Contoh:
- Menganalisis proses kompresi gas menggunakan kapasitas panas konstan, padahal seharusnya menggunakan kapasitas panas isokhorik.
- Menganalisis pemuaian gas menggunakan kapasitas panas konstan, padahal seharusnya menggunakan kapasitas panas isokhorik.
Mencampur Konvensi Tanda
Dalam termodinamika, ada dua konvensi tanda yang berbeda:
Konvensi Tanda Kalor
Kalor yang masuk ke sistem positif, kalor yang keluar negatif.
Konvensi Tanda Kerja
Kerja yang dilakukan oleh sistem positif, kerja yang dilakukan pada sistem negatif.Mencampur konvensi tanda dapat menyebabkan kesalahan dalam menghitung perubahan energi dalam.Contoh:
- Menggunakan konvensi tanda kalor untuk kerja dan sebaliknya.
- Menggunakan konvensi tanda kerja untuk kalor dan sebaliknya.
Aplikasi Hukum 1 Termodinamika dalam Bidang Lain

Hukum 1 termodinamika memiliki aplikasi luas di luar bidang fisika, termasuk dalam bidang teknik, kimia, dan biologi. Hukum ini memberikan dasar untuk memahami dan memprediksi perilaku sistem termodinamika, yang memiliki peran penting dalam berbagai proses dan teknologi.
Teknik
Dalam teknik, hukum 1 termodinamika digunakan untuk menganalisis dan merancang mesin, sistem pembangkit listrik, dan sistem pemanasan dan pendinginan. Misalnya, dalam mesin pembakaran internal, hukum ini digunakan untuk menentukan efisiensi termal dan output daya mesin.
Kimia
Dalam kimia, hukum 1 termodinamika digunakan untuk mempelajari reaksi kimia dan kesetimbangan. Hukum ini membantu memprediksi perubahan entalpi dan entropi reaksi, yang merupakan faktor penting dalam menentukan kelayakan dan arah reaksi.
Biologi
Dalam biologi, hukum 1 termodinamika digunakan untuk memahami proses metabolisme dan transfer energi dalam organisme hidup. Hukum ini menjelaskan bagaimana organisme mempertahankan suhu tubuh, mengekstrak energi dari makanan, dan melakukan berbagai proses fisiologis.
Kesimpulan
Dengan memahami hukum 1 termodinamika dan penerapannya, kita dapat memprediksi dan mengendalikan proses energi dalam berbagai sistem, mulai dari mesin hingga proses biologis. Prinsip ini terus menjadi dasar bagi kemajuan ilmiah dan teknologi di berbagai bidang.
Tanya Jawab (Q&A)
Apa saja jenis-jenis sistem termodinamika?
Sistem tertutup, sistem terbuka, dan sistem terisolasi.
Bagaimana hukum 1 termodinamika berlaku pada sistem terisolasi?
Energi total sistem terisolasi tetap konstan.
Apa saja kesalahan umum dalam menerapkan hukum 1 termodinamika?
Mengabaikan kerja yang dilakukan oleh atau terhadap sistem, dan mengasumsikan bahwa semua proses dapat dibalikkan.
