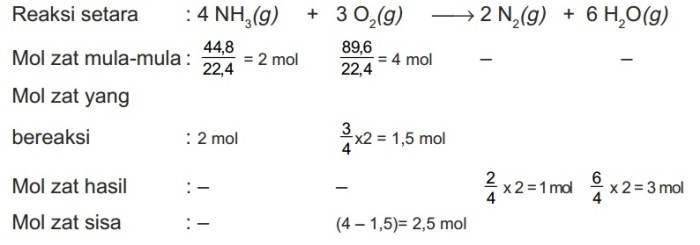
Perhitungan kimia merupakan landasan fundamental untuk memahami sifat materi dan reaksi kimia. Prinsip-prinsip perhitungan kimia memungkinkan kita untuk memprediksi hasil reaksi, menghitung jumlah reaktan dan produk, serta memahami dinamika proses kimia. Artikel ini akan menyajikan contoh soal perhitungan kimia yang mencakup berbagai konsep penting, termasuk stoikiometri, termodinamika, kinetika, dan kesetimbangan kimia.
Dengan menguasai konsep-konsep ini, kita dapat memperoleh pemahaman yang lebih mendalam tentang dunia kimia, memecahkan masalah secara efektif, dan membuat prediksi tentang perilaku sistem kimia.
Konsep Dasar Perhitungan Kimia

Perhitungan kimia adalah alat penting yang digunakan untuk memecahkan masalah dan memprediksi hasil reaksi kimia. Perhitungan ini melibatkan penggunaan prinsip-prinsip dasar seperti satuan, konversi satuan, dan angka penting.
Satuan dan Konversi Satuan
Dalam perhitungan kimia, satuan sangat penting untuk memastikan konsistensi dan akurasi. Satuan umum yang digunakan dalam kimia meliputi gram (g), liter (L), dan mol (mol). Untuk mengonversi antar satuan, faktor konversi digunakan. Misalnya, untuk mengonversi gram menjadi kilogram, faktor konversi 1 kg = 1000 g dapat digunakan.
Angka Penting
Angka penting adalah digit yang signifikan dalam pengukuran. Angka nol yang diapit oleh angka bukan nol selalu signifikan. Nol di akhir bilangan juga signifikan jika ada titik desimal. Angka nol di awal bilangan tidak signifikan. Jumlah angka penting dalam hasil perhitungan tidak boleh lebih dari jumlah angka penting dalam pengukuran dengan angka penting paling sedikit.
Contoh Soal
Contoh soal: Hitung massa dalam gram dari 2,5 mol NaCl.Massa molar NaCl = 58,44 g/molLangkah-langkah penyelesaian:
1. Konversi mol ke gram menggunakan massa molar
Massa = 2,5 mol x 58,44 g/mol = 146,1 g
Bulatkan hasil ke angka penting paling sedikit, yaitu 2:
Massa = 146 gOleh karena itu, massa NaCl dalam gram adalah 146 g.
Stoikiometri
Stoikiometri adalah cabang kimia yang mempelajari hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia. Persamaan reaksi kimia menyatakan komposisi kualitatif dan kuantitatif reaktan dan produk yang terlibat dalam reaksi.
Mol dan Hubungan Antar Mol
Mol (mol) adalah satuan jumlah zat dalam Sistem Satuan Internasional (SI). Satu mol suatu zat mengandung 6,022 × 10 23 entitas dasar zat tersebut, yang dapat berupa atom, molekul, ion, atau elektron.Hubungan antar mol dapat dinyatakan melalui massa molar dan volume molar.
Massa molar suatu zat adalah massa satu mol zat tersebut dalam gram. Volume molar suatu gas pada suhu dan tekanan standar (STP) adalah 22,4 liter per mol.
Contoh Soal Stoikiometri
Soal:Berapa massa natrium klorida (NaCl) yang dapat dihasilkan dari reaksi 2 mol natrium (Na) dengan 1 mol klorin (Cl 2 )?Jawaban:Dari persamaan reaksi:
Na + Cl 2 → 2NaCl
Dari massa molar NaCl: 58,44 g/molPerhitungan:Massa NaCl = 2 mol Na × (1 mol NaCl / 2 mol Na) × 58,44 g/mol =
*116,88 g
Termodinamika Kimia

Termodinamika kimia adalah cabang kimia yang mempelajari perubahan energi dalam reaksi kimia. Hukum-hukum termodinamika memberikan kerangka kerja untuk memahami dan memprediksi arah dan kelayakan reaksi kimia.
Hukum Termodinamika
Ada tiga hukum utama termodinamika:
- Hukum Kekekalan Energi: Energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah dari satu bentuk ke bentuk lainnya.
- Hukum Entropi: Entropi (ketidakteraturan) suatu sistem terisolasi selalu meningkat seiring waktu.
- Hukum Energi Bebas Gibbs: Reaksi kimia cenderung berlangsung spontan menuju keadaan dengan energi bebas Gibbs terendah.
Perubahan Entalpi, Entropi, dan Energi Bebas Gibbs
Perubahan entalpi (ΔH), entropi (ΔS), dan energi bebas Gibbs (ΔG) adalah besaran termodinamika yang dapat digunakan untuk memprediksi kelayakan reaksi kimia.
- ΔH: Mengukur perubahan panas yang menyertai reaksi kimia. Reaksi eksotermik (melepaskan panas) memiliki ΔH negatif, sedangkan reaksi endotermik (menyerap panas) memiliki ΔH positif.
- ΔS: Mengukur perubahan entropi sistem. Reaksi yang meningkatkan entropi memiliki ΔS positif, sedangkan reaksi yang menurunkan entropi memiliki ΔS negatif.
- ΔG: Mengukur energi yang tersedia untuk melakukan kerja pada suhu dan tekanan konstan. Reaksi spontan memiliki ΔG negatif, sedangkan reaksi tidak spontan memiliki ΔG positif.
Kinetika Kimia

Kinetika kimia adalah studi tentang laju reaksi dan faktor-faktor yang mempengaruhinya. Laju reaksi adalah perubahan konsentrasi reaktan atau produk terhadap waktu.Orde reaksi adalah ketergantungan laju reaksi pada konsentrasi reaktan. Orde reaksi ditentukan secara eksperimental dengan mengukur laju reaksi pada konsentrasi reaktan yang berbeda.Beberapa
faktor yang mempengaruhi laju reaksi meliputi konsentrasi reaktan, suhu, luas permukaan, dan katalis.
Kesetimbangan Kimia

Kesetimbangan kimia adalah keadaan di mana laju reaksi maju sama dengan laju reaksi balik, sehingga konsentrasi reaktan dan produk tidak berubah seiring waktu. Konstanta kesetimbangan (Kc) adalah rasio konsentrasi produk terhadap konsentrasi reaktan pada kesetimbangan, yang merupakan nilai tetap pada suhu tertentu.Faktor-faktor
yang memengaruhi posisi kesetimbangan meliputi:
- Perubahan konsentrasi reaktan atau produk
- Perubahan suhu
- Penambahan katalis
- Perubahan tekanan (untuk reaksi gas)
Jenis-Jenis Kesetimbangan
Kesetimbangan dapat diklasifikasikan menjadi beberapa jenis:
-
-*Homogen
Reaksi terjadi dalam satu fasa, baik gas, cair, atau padat. Contoh: reaksi disosiasi N2O4 menjadi 2NO2.
-*Heterogen
Reaksi terjadi pada antarmuka dua atau lebih fasa, seperti gas-cair, gas-padat, atau cair-padat. Contoh: reaksi pembentukan amonia dari nitrogen dan hidrogen.
-*Ionik
Reaksi terjadi dalam larutan, melibatkan ion-ion sebagai reaktan atau produk. Contoh: reaksi asam-basa.
Contoh Soal Perhitungan Konstanta Kesetimbangan
Soal:Suatu reaksi kesetimbangan memiliki konsentrasi reaktan [A] = 0,2 M dan konsentrasi produk [B] = 0,4 M.
Hitung konstanta kesetimbangan (Kc) untuk reaksi tersebut.Penyelesaian:Kc = [B]/[A] = 0,4 M / 0,2 M = 2Prediksi Arah Reaksi dalam Sistem KesetimbanganArah reaksi dalam sistem kesetimbangan dapat diprediksi menggunakan prinsip Le Chatelier. Jika konsentrasi reaktan atau produk diubah, sistem akan bergeser ke arah yang mengurangi perubahan tersebut.
Misalnya, jika konsentrasi reaktan ditambahkan, sistem akan bergeser ke arah produk untuk mengurangi konsentrasi reaktan.
Penutupan
Contoh soal perhitungan kimia yang disajikan dalam artikel ini memberikan wawasan yang berharga tentang aplikasi praktis prinsip-prinsip kimia. Dengan memahami konsep-konsep ini dan berlatih menyelesaikan soal, kita dapat mengembangkan keterampilan analitis yang kuat dan memperoleh apresiasi yang lebih besar terhadap kekuatan perhitungan kimia dalam memajukan pengetahuan ilmiah.
Jawaban yang Berguna
Apa saja prinsip dasar perhitungan kimia?
Prinsip dasar perhitungan kimia meliputi penggunaan satuan, konversi satuan, dan angka penting untuk memastikan akurasi dan presisi dalam perhitungan.
Apa itu stoikiometri?
Stoikiometri adalah studi tentang hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia, menggunakan konsep mol, massa molar, dan volume molar.
Apa saja hukum termodinamika?
Hukum termodinamika meliputi hukum kekekalan energi, hukum entropi, dan hukum energi bebas Gibbs, yang mengatur perubahan energi, entropi, dan potensial reaksi kimia.
Apa itu kinetika kimia?
Kinetika kimia adalah studi tentang laju reaksi, orde reaksi, dan faktor-faktor yang memengaruhi laju reaksi, seperti konsentrasi, suhu, dan katalis.
Apa itu kesetimbangan kimia?
Kesetimbangan kimia adalah keadaan di mana laju reaksi maju dan mundur sama, menghasilkan konsentrasi konstan reaktan dan produk, yang dapat diprediksi menggunakan konstanta kesetimbangan.