Elektrolisis, suatu proses transformasi kimia menggunakan arus listrik, merupakan teknik yang vital dalam berbagai bidang. Memahami prinsip dan penerapannya sangat penting, dan contoh soal memainkan peran krusial dalam mengasah pemahaman ini.
Contoh soal sel elektrolisis memberikan kesempatan untuk mempraktikkan konsep-konsep teoritis dan mengembangkan keterampilan pemecahan masalah. Dengan menguraikan langkah-langkah penyelesaian dan membahas implikasi praktis, contoh soal ini memberikan wawasan berharga tentang aplikasi elektrolisis dalam kehidupan nyata.
Pengertian Elektrolisis
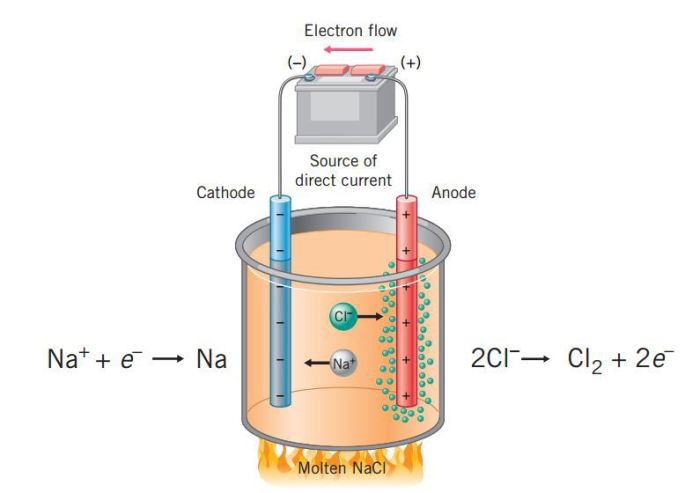
Elektrolisis adalah proses penguraian senyawa kimia menggunakan arus listrik. Proses ini melibatkan penerapan arus listrik melalui larutan atau lelehan elektrolit, menyebabkan reaksi kimia yang menghasilkan penguraian senyawa menjadi unsur-unsurnya.
Proses elektrolisis melibatkan dua elektroda, yaitu anoda dan katoda, yang terhubung ke sumber arus listrik. Elektrolit, yang merupakan senyawa yang akan diuraikan, dilarutkan atau dilelehkan dan ditempatkan dalam wadah antara elektroda. Ketika arus listrik dialirkan melalui elektrolit, ion-ion dalam larutan tertarik ke elektroda dengan muatan yang berlawanan.
Contoh Soal Elektrolisis
Elektrolisis merupakan proses penguraian suatu senyawa kimia menggunakan arus listrik. Berikut ini adalah contoh soal elektrolisis yang umum ditemukan:
Langkah-langkah Penyelesaian Soal
1.
-
-*Tulis persamaan reaksi redoks
Tentukan reaksi redoks yang terjadi selama elektrolisis.
- 2.
- 3.
- 4.
- 5.
-*Identifikasi elektroda
Tentukan elektroda tempat terjadi reaksi oksidasi dan reduksi.
-*Hitung arus listrik
Hitung arus listrik yang diperlukan untuk menguraikan sejumlah zat tertentu menggunakan hukum Faraday.
-*Tentukan waktu elektrolisis
Hitung waktu yang diperlukan untuk menguraikan sejumlah zat tertentu menggunakan persamaan waktu elektrolisis.
-*Analisis hasil
Tentukan hasil elektrolisis, seperti volume gas yang dihasilkan atau massa zat yang diendapkan.
Cara Melakukan Elektrolisis
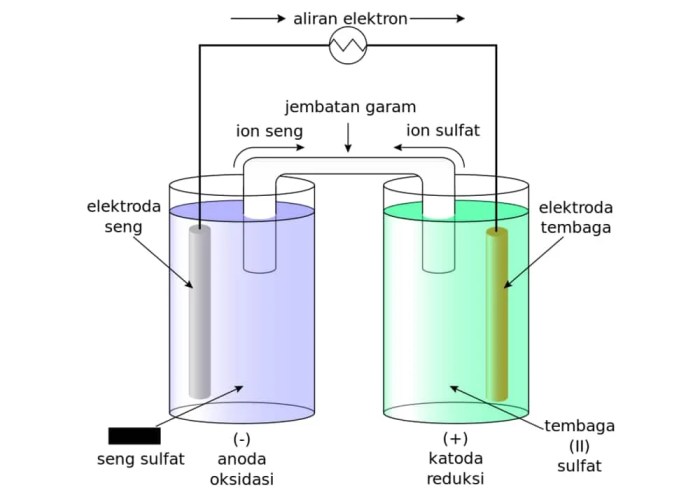
Elektrolisis adalah proses pemisahan unsur-unsur suatu senyawa dengan menggunakan arus listrik. Proses ini biasanya dilakukan di laboratorium untuk memisahkan unsur-unsur logam dari senyawa garamnya.
Untuk melakukan elektrolisis, diperlukan peralatan berikut:
- Sumber arus listrik (baterai atau catu daya)
- Elektroda (anoda dan katoda)
- Larutan elektrolit (senyawa garam yang akan dipisahkan)
- Bejana elektrolisis
Tindakan pencegahan keselamatan yang harus diperhatikan saat melakukan elektrolisis:
- Gunakan sarung tangan dan kacamata pengaman.
- Lakukan elektrolisis di tempat yang berventilasi baik.
- Jangan menyentuh elektroda saat arus listrik mengalir.
- Matikan sumber arus listrik sebelum melakukan perubahan apa pun pada rangkaian.
Prosedur Langkah Demi Langkah
- Siapkan bejana elektrolisis dengan larutan elektrolit.
- Hubungkan elektroda ke sumber arus listrik, anoda ke kutub positif dan katoda ke kutub negatif.
- Hidupkan sumber arus listrik dan atur arus listrik yang mengalir.
- Amati perubahan yang terjadi pada larutan elektrolit dan elektroda.
- Matikan sumber arus listrik setelah reaksi selesai.
Aplikasi Elektrolisis
Elektrolisis memiliki beragam aplikasi di berbagai bidang, termasuk industri dan penelitian. Proses ini digunakan untuk memproduksi bahan kimia, memurnikan logam, dan melakukan berbagai proses elektrokimia.
Berikut adalah beberapa contoh spesifik penggunaan elektrolisis dalam kehidupan sehari-hari:
Industri
- Produksi klorin dan natrium hidroksida untuk industri pulp dan kertas, tekstil, dan bahan kimia.
- Pemurnian aluminium dari bijih bauksit.
- Pelapisan logam untuk melindungi dan meningkatkan sifat permukaan logam.
- Produksi hidrogen dan oksigen melalui elektrolisis air.
Penelitian
- Studi reaksi elektrokimia untuk mengembangkan bahan dan proses baru.
- Pengembangan sel bahan bakar dan baterai yang lebih efisien.
- Elektrosintesis bahan organik dan anorganik.
Kehidupan Sehari-hari
- Pengisian ulang baterai yang dapat diisi ulang (misalnya, baterai mobil, laptop).
- Elektroplating perhiasan dan barang-barang dekoratif.
- Pemurnian air melalui elektrolisis, yang menghilangkan kontaminan dan patogen.
Tabel Hasil Elektrolisis

Elektrolisis menghasilkan berbagai produk tergantung pada elektroda dan elektrolit yang digunakan. Tabel berikut merangkum hasil elektrolisis untuk beberapa kombinasi elektroda dan elektrolit umum.
Elektroda Karbon
- Elektrolit: Larutan NaCl
- Produk: Gas klorin (Cl2) di anoda, gas hidrogen (H2) di katoda
- Reaksi kimia: 2 NaCl + 2 H2O → 2 NaOH + Cl2 + H2
- Elektrolit: Larutan CuSO4
- Produk: Tembaga (Cu) di katoda
- Reaksi kimia: CuSO4 + H2O → Cu + H2SO4 + 1/2 O2
Elektroda Platinum
- Elektrolit: Larutan H2SO4
- Produk: Gas hidrogen (H2) di kedua elektroda
- Reaksi kimia: 2 H2O → 2 H2 + O2
- Elektrolit: Larutan AgNO3
- Produk: Perak (Ag) di katoda
- Reaksi kimia: AgNO3 + H2O → Ag + HNO3 + 1/2 O2
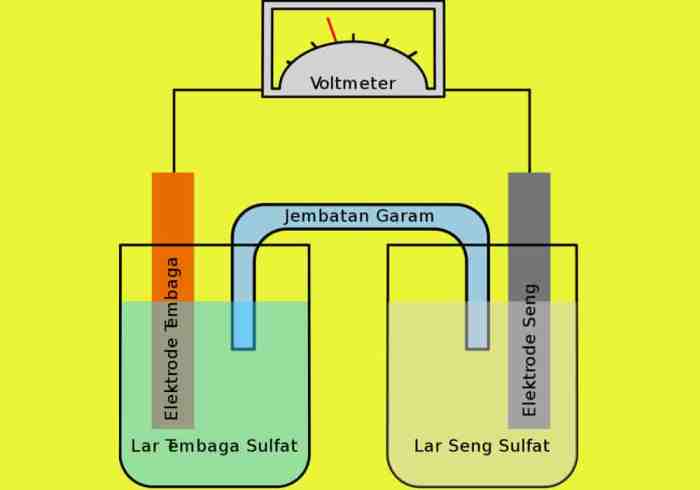
Ilustrasi Proses Elektrolisis
Elektrolisis adalah proses kimia yang melibatkan penggunaan arus listrik untuk memicu reaksi kimia yang tidak terjadi secara spontan. Proses ini memanfaatkan sel elektrolisis, perangkat yang terdiri dari elektroda dan larutan elektrolit.
Bagian-bagian Sel Elektrolisis
- Elektroda Positif (Anoda): Elektroda tempat terjadi oksidasi (pelepasan elektron).
- Elektroda Negatif (Katoda): Elektroda tempat terjadi reduksi (penerimaan elektron).
- Larutan Elektrolit: Larutan yang mengandung ion-ion yang dapat bergerak bebas, memungkinkan aliran arus listrik.
- Sumber Arus Listrik: Perangkat yang menyediakan arus listrik ke sel.
Faktor-Faktor yang Mempengaruhi Elektrolisis
Proses elektrolisis dipengaruhi oleh beberapa faktor yang dapat memengaruhi laju dan efisiensinya. Faktor-faktor tersebut meliputi konsentrasi elektrolit, suhu, dan jarak elektroda.
Konsentrasi Elektrolit
Konsentrasi elektrolit dalam larutan memainkan peran penting dalam elektrolisis. Semakin tinggi konsentrasi elektrolit, semakin banyak ion yang tersedia untuk bereaksi pada elektroda, sehingga meningkatkan laju elektrolisis. Hal ini karena konsentrasi yang lebih tinggi meningkatkan konduktivitas listrik larutan, memungkinkan aliran arus yang lebih besar.
Suhu
Suhu juga memengaruhi laju elektrolisis. Peningkatan suhu umumnya meningkatkan laju reaksi kimia, termasuk elektrolisis. Hal ini karena suhu yang lebih tinggi meningkatkan energi kinetik ion, sehingga lebih mudah bereaksi. Selain itu, peningkatan suhu dapat menurunkan viskositas larutan, yang selanjutnya meningkatkan mobilitas ion.
Jarak Elektroda
Jarak antara elektroda dalam sel elektrolisis juga memengaruhi laju elektrolisis. Jarak yang lebih pendek antara elektroda mengurangi resistansi listrik larutan, sehingga memungkinkan aliran arus yang lebih besar. Hal ini mengarah pada peningkatan laju elektrolisis. Namun, jarak elektroda yang terlalu dekat dapat menyebabkan polarisasi konsentrasi, yang dapat menurunkan efisiensi elektrolisis.Dengan
mengoptimalkan faktor-faktor ini, seperti meningkatkan konsentrasi elektrolit, menaikkan suhu, dan mengurangi jarak elektroda, laju dan efisiensi elektrolisis dapat ditingkatkan secara signifikan untuk mencapai hasil yang diinginkan.
Penutup

Contoh soal sel elektrolisis berfungsi sebagai batu loncatan yang efektif untuk menguasai konsep elektrolisis. Dengan memecahkan soal-soal ini, siswa dan peneliti dapat memperkuat pemahaman mereka tentang proses elektrokimia, faktor-faktor yang mempengaruhinya, dan aplikasinya yang luas. Praktik berkelanjutan dan eksplorasi lebih lanjut akan membuka jalan bagi penemuan dan inovasi baru di bidang elektrolisis.
Pertanyaan dan Jawaban
Apa saja tindakan pencegahan keselamatan yang harus diperhatikan saat melakukan elektrolisis?
Kenakan sarung tangan, gunakan kacamata pengaman, dan bekerja di area berventilasi baik karena proses ini dapat menghasilkan gas berbahaya dan percikan.
Bagaimana cara meningkatkan efisiensi elektrolisis?
Tingkatkan konsentrasi elektrolit, tingkatkan suhu (dalam batas wajar), dan kurangi jarak antar elektroda.
Apa produk yang dihasilkan ketika air dielektrolisis?
Hidrogen dan oksigen
Bagaimana cara menentukan jumlah zat yang dihasilkan dalam elektrolisis?
Gunakan hukum Faraday tentang elektrolisis, yang menyatakan bahwa massa zat yang dihasilkan berbanding lurus dengan jumlah muatan listrik yang dilewatkan melalui sel.