Dalam kimia, struktur Lewis memberikan representasi visual dari susunan atom dan ikatan dalam suatu molekul. Dengan memahami konsep ini, kita dapat memprediksi sifat dan reaktivitas molekul, membuka pintu untuk pemahaman yang lebih dalam tentang dunia di sekitar kita.
Struktur Lewis dibangun berdasarkan prinsip dasar aturan oktet, yang menyatakan bahwa atom cenderung membentuk ikatan untuk memperoleh konfigurasi elektron yang stabil dengan delapan elektron valensi (kecuali hidrogen, yang hanya membutuhkan dua). Dengan menggambar titik-titik yang mewakili elektron valensi dan garis yang menunjukkan ikatan, kita dapat menggambarkan ikatan kimia dalam suatu molekul secara intuitif.
Struktur Lewis
Struktur Lewis adalah representasi diagram dari suatu molekul yang menunjukkan ikatan antar atom dan pasangan elektron bebas. Struktur ini memberikan gambaran visual tentang distribusi elektron dalam suatu molekul dan dapat digunakan untuk memprediksi sifat kimia dan fisika molekul tersebut.
Cara Menggambar Struktur Lewis
- Hitung jumlah elektron valensi total dari semua atom dalam molekul.
- Tentukan atom pusat, biasanya atom yang memiliki elektronegativitas paling rendah.
- Pasangkan elektron valensi dari atom pusat dengan atom lain membentuk ikatan tunggal.
- Tambahkan elektron valensi yang tersisa sebagai pasangan elektron bebas pada atom yang sesuai.
- Jika ada elektron valensi yang tersisa, gunakan untuk membentuk ikatan rangkap atau rangkap tiga.
- Sesuaikan struktur untuk memenuhi aturan oktet, di mana setiap atom (kecuali hidrogen) dikelilingi oleh delapan elektron.
Contoh Struktur Lewis
- Metana (CH₄): H:C:HH:C:H
- Air (H₂O): H:O:H
- Amonia (NH₃): H:N:HH:N:H
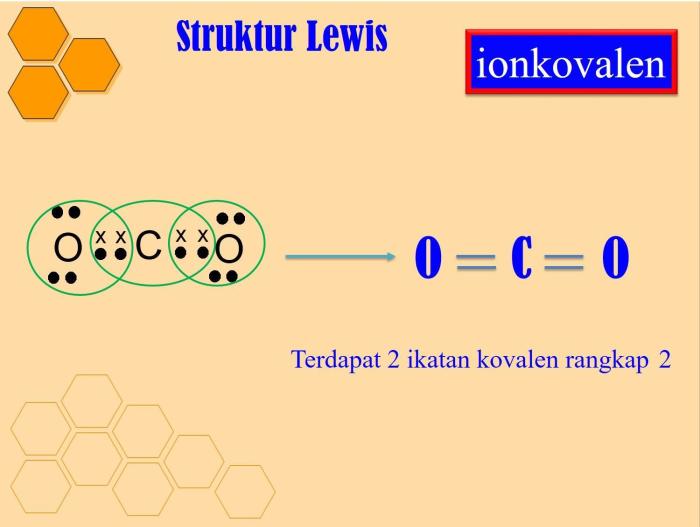
- Karbon dioksida (CO₂): O::C::O
Aturan Oktet
Aturan oktet menyatakan bahwa atom cenderung membentuk ikatan kimia sedemikian rupa sehingga mereka memiliki delapan elektron valensi di kulit terluarnya. Konfigurasi ini, yang dikenal sebagai konfigurasi oktet, stabil dan tidak reaktif secara kimia.
Penerapan Aturan Oktet pada Struktur Lewis
- Dalam struktur Lewis, atom-atom digambarkan sebagai titik atau lingkaran dengan garis yang mewakili ikatan kimia.
- Untuk memenuhi aturan oktet, atom cenderung memperoleh atau kehilangan elektron untuk membentuk ikatan kovalen.
- Ikatan kovalen tunggal dibentuk ketika dua atom berbagi dua elektron, sedangkan ikatan rangkap dua atau rangkap tiga dibentuk ketika mereka berbagi empat atau enam elektron.
Pengecualian Aturan Oktet
Meskipun aturan oktet adalah pedoman yang berguna, ada beberapa pengecualian:
- Atom dengan Kurang dari Empat Elektron Valensi: Atom seperti hidrogen (H) dan helium (He) hanya memiliki satu atau dua elektron valensi dan membentuk ikatan kovalen dengan berbagi elektron tersebut.
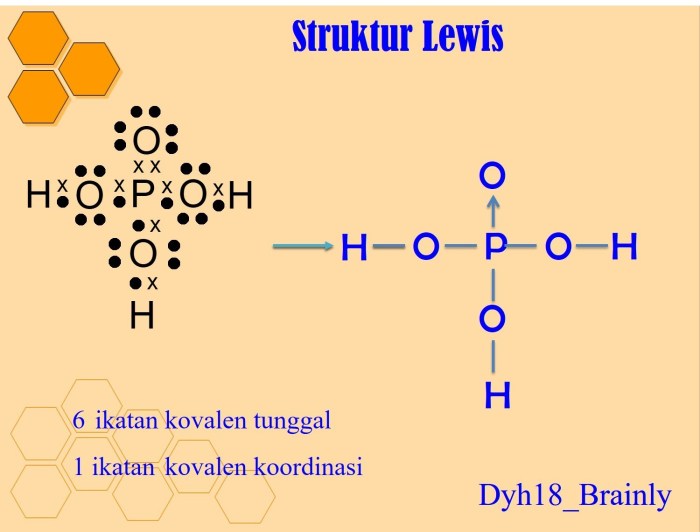
- Atom dengan Lebih dari Delapan Elektron Valensi: Atom seperti fosfor (P) dan belerang (S) dapat mengembang lebih dari delapan elektron valensi dan membentuk ikatan kovalen dengan atom lain yang memiliki pasangan elektron bebas.
- Senyawa Ionik: Dalam senyawa ionik, atom tidak berbagi elektron tetapi memperoleh atau kehilangan elektron untuk membentuk ion dengan konfigurasi oktet.
Ikatan Kovalen
Ikatan kovalen merupakan jenis ikatan kimia yang terbentuk ketika dua atom berbagi pasangan elektron. Pembentukan ikatan kovalen didasarkan pada prinsip bahwa atom cenderung mencapai konfigurasi elektron yang stabil, yaitu keadaan dengan delapan elektron valensi (aturan oktet).
Jenis-jenis Ikatan Kovalen
Ada tiga jenis utama ikatan kovalen:
- Ikatan Kovalen Tunggal: Terbentuk ketika dua atom berbagi sepasang elektron.
- Ikatan Kovalen Rangkap Dua: Terbentuk ketika dua atom berbagi dua pasang elektron.
- Ikatan Kovalen Rangkap Tiga: Terbentuk ketika dua atom berbagi tiga pasang elektron.
Pembentukan Ikatan Kovalen Menggunakan Struktur Lewis
Struktur Lewis adalah representasi diagramatik dari ikatan kovalen dalam suatu molekul. Untuk membentuk struktur Lewis, ikuti langkah-langkah berikut:
- Tentukan jumlah elektron valensi untuk setiap atom.
- Pasangkan elektron valensi untuk membentuk ikatan tunggal antara atom-atom.
- Jika ada elektron valensi yang tersisa, tempatkan sebagai pasangan elektron bebas pada atom yang sesuai.
- Periksa apakah semua atom memiliki delapan elektron valensi (atau dua untuk hidrogen).
- Jika belum, sesuaikan struktur dengan membentuk ikatan rangkap atau rangkap tiga sesuai kebutuhan.
Resonansi
Resonansi adalah fenomena kimia yang terjadi ketika sebuah molekul dapat direpresentasikan oleh lebih dari satu struktur Lewis. Struktur-struktur ini disebut struktur resonansi, dan mereka memiliki distribusi elektron yang berbeda tetapi energi yang sama.
Konsep Resonansi
Konsep resonansi menyatakan bahwa struktur resonansi adalah representasi yang sama dari molekul yang sama. Tidak ada satu struktur resonansi yang lebih benar dari yang lain, dan semua struktur resonansi berkontribusi pada struktur sebenarnya dari molekul.
Contoh Struktur Resonansi
- Ozon (O3): Ozon memiliki dua struktur resonansi, di mana satu oksigen berikatan ganda dengan dua oksigen lainnya, dan oksigen lainnya berikatan tunggal dengan dua oksigen.
- Benzena (C6H6): Benzena memiliki enam struktur resonansi, di mana setiap karbon berikatan tunggal dengan dua karbon lainnya dan satu hidrogen.
Pengaruh Resonansi pada Stabilitas Molekul
Resonansi dapat menstabilkan molekul dengan mendistribusikan muatan elektron. Molekul dengan struktur resonansi lebih stabil daripada molekul dengan satu struktur Lewis, karena muatan negatif terdelokalisasi pada area yang lebih luas.
Struktur Lewis Senyawa Ionik
Senyawa ionik terbentuk dari logam dan non-logam. Senyawa ionik dibentuk ketika logam melepaskan elektron ke non-logam, membentuk ion positif (kation) dan ion negatif (anion). Struktur Lewis senyawa ionik tidak menunjukkan ikatan kovalen, melainkan menggambarkan transfer elektron yang terjadi.
Cara Menggambar Struktur Lewis Senyawa Ionik
Untuk menggambar struktur Lewis senyawa ionik:
- Tuliskan simbol logam dan non-logam berdampingan.
- Tentukan muatan ion logam dengan melihat tabel periodik.
- Tentukan muatan ion non-logam dengan melihat muatan logam dan kaidah muatan netral.
- Gambar ion logam dengan muatannya di atas simbol.
- Gambar ion non-logam dengan muatannya di atas simbol.
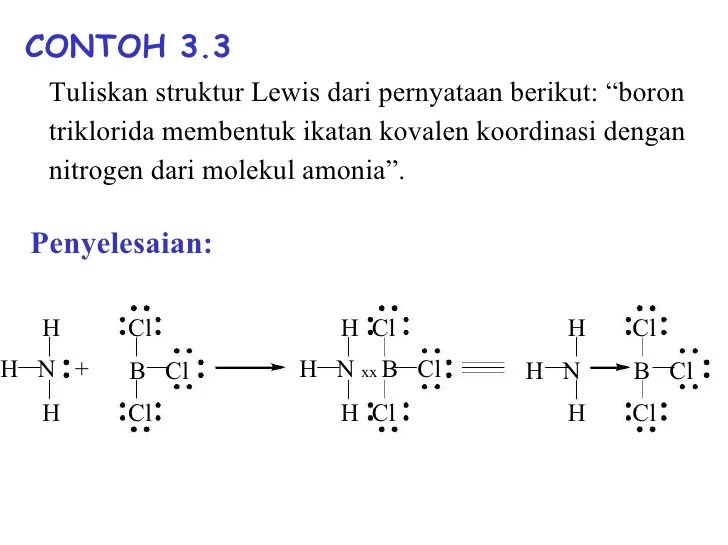
Struktur Lewis Senyawa Koordinasi

Senyawa koordinasi adalah senyawa kimia yang mengandung ikatan koordinasi, yaitu ikatan antara atom atau ion logam (disebut pusat logam) dengan ligan (atom, ion, atau molekul yang menyumbangkan pasangan elektron).
Konsep Senyawa Koordinasi
Senyawa koordinasi terdiri dari:
- Pusat logam, biasanya logam transisi atau logam golongan utama.
- Ligan, yang dapat berupa anion, molekul netral, atau ion kompleks.
- Bilangan koordinasi, yang merupakan jumlah ligan yang terikat pada pusat logam.
Struktur Lewis Senyawa Koordinasi
Struktur Lewis senyawa koordinasi menunjukkan distribusi elektron dalam molekul. Langkah-langkah menggambar struktur Lewis senyawa koordinasi meliputi:
- Tentukan pusat logam dan ligan.
- Tentukan bilangan oksidasi pusat logam.
- Tentukan pasangan elektron bebas pada ligan.
- Gambar kerangka struktur dengan pusat logam di tengah dan ligan di sekitarnya.
- Distribusikan pasangan elektron bebas dari ligan ke pusat logam untuk membentuk ikatan koordinasi.
- Tambahkan muatan formal pada pusat logam dan ligan untuk menyeimbangkan muatan total.
Contoh Struktur Lewis Senyawa Koordinasi
Contoh struktur Lewis senyawa koordinasi:
- [Cu(NH3)4]2+
- [Fe(CN)6]4-
- [Co(en)3]3+ (en = etilenadiamina)
Aplikasi Struktur Lewis
Struktur Lewis adalah representasi visual yang menggambarkan ikatan antar atom dalam suatu molekul. Struktur ini memiliki berbagai aplikasi dalam memprediksi sifat dan reaktivitas molekul.
Prediksi Sifat Molekul
Struktur Lewis dapat digunakan untuk memprediksi bentuk molekul berdasarkan teori domain elektron valensi (VSEPR). Teori ini menyatakan bahwa pasangan elektron (ikatan dan tidak terikat) saling tolak menolak, sehingga meminimalkan tolakan dan menentukan bentuk molekul. Misalnya, molekul metana (CH4) memiliki struktur tetrahedral karena empat pasangan elektron di sekitar atom karbon saling tolak menolak.
Prediksi Reaktivitas Molekul
Struktur Lewis juga dapat digunakan untuk memprediksi reaktivitas molekul. Molekul dengan ikatan rangkap atau tidak jenuh lebih reaktif karena ikatan tersebut lebih lemah dan lebih mudah putus. Selain itu, struktur Lewis dapat membantu mengidentifikasi gugus fungsi dalam suatu molekul, yang merupakan bagian dari molekul yang menentukan reaktivitasnya.
Keterbatasan Struktur Lewis
Meskipun berguna, struktur Lewis memiliki beberapa keterbatasan:* Tidak dapat memprediksi semua sifat molekul, seperti warna dan magnetisme.
- Tidak memperhitungkan efek resonansi, di mana elektron terdelokalisasi di seluruh molekul.
- Tidak dapat memprediksi reaksi yang melibatkan ikatan ionik atau logam.
Ringkasan Penutup
Struktur Lewis telah menjadi alat yang sangat berharga dalam kimia, memberikan wawasan tentang struktur dan ikatan molekul. Meskipun memiliki beberapa keterbatasan, struktur Lewis tetap menjadi titik awal yang penting untuk memahami sifat dan reaktivitas materi. Dengan mempelajari contoh-contoh soal, kita dapat menguasai teknik menggambar struktur Lewis dan membuka potensi untuk mengeksplorasi dunia kimia yang menakjubkan.
Pertanyaan Umum (FAQ)
Apa perbedaan antara struktur Lewis dan rumus kimia?
Struktur Lewis menunjukkan susunan atom dan ikatan dalam suatu molekul, sementara rumus kimia hanya mencantumkan jenis dan jumlah atom dalam molekul tersebut.
Bagaimana cara menggambar struktur Lewis untuk senyawa ionik?
Untuk senyawa ionik, elektron ditransfer dari atom logam ke atom non-logam, membentuk ion bermuatan. Struktur Lewis senyawa ionik menunjukkan ion-ion ini dan tidak ada ikatan kovalen.
Apa aplikasi struktur Lewis dalam memprediksi reaktivitas molekul?
Struktur Lewis dapat digunakan untuk mengidentifikasi situs reaktif dalam suatu molekul, seperti pasangan elektron bebas atau atom dengan muatan parsial, yang dapat membantu memprediksi kemungkinan reaksi kimia.