Termokimia, cabang kimia yang mempelajari perubahan energi dalam reaksi kimia, memainkan peran penting dalam berbagai bidang ilmiah dan teknologi. Dari desain sel bahan bakar hingga produksi bahan bakar alternatif, prinsip-prinsip termokimia sangat penting untuk memahami dan memanipulasi proses energi.
Artikel ini memberikan tinjauan komprehensif tentang termokimia, menyoroti konsep-konsep mendasar, jenis-jenis reaksi, dan aplikasi praktisnya. Selain itu, artikel ini menyajikan contoh soal termokimia essay yang dikurasi dengan cermat, dilengkapi dengan panduan langkah demi langkah untuk menyelesaikannya.
Definisi Termokimia
Termokimia merupakan cabang kimia yang mempelajari perubahan energi yang menyertai reaksi kimia. Perubahan energi ini dapat berupa penyerapan (reaksi endotermik) atau pelepasan (reaksi eksotermik) panas.
Sebagai contoh, reaksi pembakaran metana merupakan reaksi eksotermik yang melepaskan panas. Reaksi ini dapat ditulis sebagai:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O(l) + energi
Jenis-Jenis Reaksi Termokimia

Reaksi termokimia dapat diklasifikasikan menjadi dua jenis utama berdasarkan perubahan entalpi yang terjadi:
Reaksi Eksotermik
Reaksi eksotermik adalah reaksi kimia yang melepaskan panas ke lingkungan. Artinya, perubahan entalpi negatif (ΔH < 0). Pada reaksi ini, energi kimia dari reaktan lebih besar dari energi kimia produk. Akibatnya, kelebihan energi dilepaskan ke lingkungan sebagai panas. Contoh reaksi eksotermik: * Pembakaran metana: CH₄ + 2O₂ → CO₂ + 2H₂O + panas - Reaksi netralisasi asam-basa: NaOH + HCl → NaCl + H₂O + panas
Reaksi Endotermik
Reaksi endotermik adalah reaksi kimia yang menyerap panas dari lingkungan.
Artinya, perubahan entalpi positif (ΔH > 0). Pada reaksi ini, energi kimia produk lebih besar dari energi kimia reaktan. Akibatnya, panas dari lingkungan diserap untuk menyediakan energi yang dibutuhkan untuk memecah ikatan reaktan dan membentuk produk.Contoh reaksi endotermik:* Pembuatan amonia: N₂ + 3H₂ → 2NH₃ + panas
Penguraian air
2H₂O → 2H₂ + O₂ + panas
Entalpi Reaksi
Entalpi reaksi adalah perubahan entalpi yang terjadi selama reaksi kimia. Ini adalah ukuran jumlah panas yang diserap atau dilepaskan oleh suatu sistem selama reaksi pada tekanan konstan. Reaksi eksotermik melepaskan panas ke lingkungan, sehingga entalpi reaksi negatif. Sebaliknya, reaksi endotermik menyerap panas dari lingkungan, sehingga entalpi reaksi positif.
Persamaan Entalpi Reaksi
Entalpi reaksi dapat dihitung menggunakan persamaan berikut:
ΔH = ΣH produk
ΣH reaktan
Dimana:
- ΔH adalah perubahan entalpi reaksi
- ΣHproduk adalah jumlah entalpi produk
- ΣHreaktan adalah jumlah entalpi reaktan
Hukum Termodinamika Pertama
Hukum Termodinamika Pertama menyatakan bahwa perubahan energi dalam suatu sistem tertutup sama dengan jumlah panas yang ditambahkan ke sistem dikurangi usaha yang dilakukan oleh sistem.
Dalam termokimia, Hukum Termodinamika Pertama diterapkan untuk menghitung perubahan entalpi, yaitu perubahan energi internal sistem pada tekanan konstan. Perubahan entalpi dapat dihitung menggunakan persamaan berikut:
ΔH = Q
W
di mana ΔH adalah perubahan entalpi, Q adalah panas yang ditambahkan ke sistem, dan W adalah usaha yang dilakukan oleh sistem.
Penerapan Hukum Termodinamika Pertama dalam Termokimia
Hukum Termodinamika Pertama dapat diterapkan dalam berbagai proses termokimia, seperti:
- Reaksi Eksotermik: Reaksi yang melepaskan panas ke lingkungan. Dalam reaksi eksotermik, ΔH negatif, yang menunjukkan bahwa panas dilepaskan dari sistem.
- Reaksi Endotermik: Reaksi yang menyerap panas dari lingkungan. Dalam reaksi endotermik, ΔH positif, yang menunjukkan bahwa panas diserap oleh sistem.
- Kalorimetri: Pengukuran perubahan entalpi reaksi menggunakan kalorimeter. Kalorimeter adalah alat yang digunakan untuk mengukur jumlah panas yang ditambahkan atau dilepaskan selama reaksi kimia.
Penerapan Termokimia
Termokimia merupakan bidang ilmu yang mempelajari perubahan energi yang menyertai reaksi kimia. Penerapannya sangat luas dalam berbagai bidang, seperti:
Desain Sel Bahan Bakar
Sel bahan bakar adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Termokimia berperan dalam menentukan efisiensi sel bahan bakar dengan menganalisis perubahan entalpi dan entropi selama reaksi.
Produksi Bahan Bakar Alternatif
Produksi bahan bakar alternatif seperti biofuel dan hidrogen membutuhkan pemahaman tentang termokimia. Analisis termokimia dapat mengoptimalkan proses produksi, mengurangi konsumsi energi, dan meningkatkan efisiensi.
Pengembangan Obat
Termokimia digunakan dalam pengembangan obat untuk memahami interaksi antara obat dan target biologis. Studi termokimia dapat memberikan informasi tentang afinitas pengikatan, aktivitas enzim, dan stabilitas obat.
Contoh Soal Termokimia

Termokimia adalah cabang kimia yang mempelajari perubahan panas yang menyertai reaksi kimia. Soal termokimia biasanya melibatkan perhitungan perubahan entalpi reaksi, yang merupakan jumlah panas yang dilepaskan atau diserap selama reaksi.
Berikut adalah beberapa contoh soal termokimia dengan berbagai tingkat kesulitan:
Soal Tingkat Dasar
- Berapa perubahan entalpi reaksi pembakaran metana (CH4)?
- Berapa jumlah panas yang dilepaskan ketika 1 mol air terbentuk dari unsur-unsurnya?
- Reaksi berikut bersifat eksotermik atau endotermik? C6H12O6 + 6O2 → 6CO2 + 6H2O
Soal Tingkat Menengah
- Hitung perubahan entalpi standar untuk reaksi berikut: 2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(l)
- Sebuah reaksi kimia melepaskan panas sebesar 100 kJ. Berapa perubahan entalpi reaksi dalam kJ/mol jika reaksi tersebut melibatkan 2 mol reaktan?
- Reaksi berikut bersifat spontan atau tidak spontan pada suhu kamar? N2(g) + O2(g) → 2NO(g)
Soal Tingkat Lanjutan
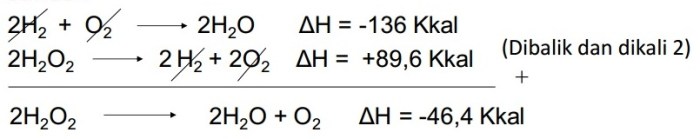
- Hitung perubahan entalpi standar untuk reaksi berikut menggunakan Hukum Hess: C(s) + 2H2(g) → CH4(g)
– Reaksi 1: C(s) + O 2 (g) → CO 2 (g); ΔH o = -393,5 kJ
– Reaksi 2: 2H 2 (g) + O 2 (g) → 2H 2 O(l); ΔH o = -571,6 kJ
– Reaksi 3: CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O(l); ΔH o = -890,4 kJ
- Jelaskan hubungan antara perubahan entalpi dan kesetimbangan kimia.
- Diskusikan aplikasi termokimia dalam bidang industri dan lingkungan.
Cara Menyelesaikan Soal Termokimia
Termokimia adalah cabang kimia yang mempelajari perubahan energi yang menyertai reaksi kimia. Soal termokimia mengharuskan kita untuk menghitung perubahan energi ini, yang biasanya dinyatakan dalam kilojoule (kJ).
Berikut adalah langkah-langkah sistematis untuk menyelesaikan soal termokimia:
Mengidentifikasi Jenis Reaksi
- Tentukan apakah reaksi tersebut eksotermik (melepaskan panas) atau endotermik (menyerap panas).
- Untuk reaksi eksotermik, perubahan entalpi (ΔH) akan negatif (dilepaskan), sedangkan untuk reaksi endotermik, ΔH akan positif (diserap).
Menulis Persamaan Kimia yang Setara
Pastikan persamaan kimia yang diberikan setara, artinya jumlah atom dan muatan pada kedua sisi persamaan harus sama.
Menggunakan Data Termodinamika
Gunakan tabel data termodinamika untuk mencari entalpi pembentukan standar (ΔH f 0 ) untuk setiap reaktan dan produk. ΔH f 0 adalah perubahan entalpi ketika satu mol suatu zat terbentuk dari unsur-unsurnya dalam keadaan standar (298 K dan 1 atm).
Menghitung Perubahan Entalpi Reaksi (ΔH)
Gunakan persamaan berikut untuk menghitung ΔH reaksi:
“`ΔH = ΣΔH f 0 (produk)
ΣΔH f 0 (reaktan)
“`
Dimana:
- ΣΔHf0 (produk) adalah jumlah ΔHf0 untuk semua produk, dikalikan dengan koefisien stoikiometrinya masing-masing.
- ΣΔHf0 (reaktan) adalah jumlah ΔHf0 untuk semua reaktan, dikalikan dengan koefisien stoikiometrinya masing-masing.
Memverifikasi Tanda ΔH
Tanda ΔH yang dihitung harus sesuai dengan jenis reaksi yang diidentifikasi pada langkah pertama. Jika tidak sesuai, periksa kembali perhitungan Anda atau persamaan kimianya.
Prosedur Praktikum Termokimia

Untuk mengukur entalpi reaksi menggunakan kalorimeter, diperlukan prosedur praktikum yang tepat. Prosedur ini meliputi langkah-langkah persiapan, pelaksanaan, dan analisis data untuk memperoleh hasil yang akurat.
Langkah-langkah Persiapan
- Siapkan kalorimeter dan pastikan telah dikalibrasi dengan benar.
- Timbang reaktan dan produk secara akurat menggunakan neraca analitik.
- Siapkan larutan yang diperlukan, seperti larutan basa atau asam, sesuai dengan reaksi yang akan dipelajari.
Langkah-langkah Pelaksanaan
- Masukkan reaktan ke dalam kalorimeter dan tambahkan larutan yang sesuai.
- Aduk larutan secara konstan dan catat perubahan suhu menggunakan termometer.
- Lanjutkan pengadukan dan pencatatan suhu hingga reaksi selesai dan suhu menjadi stabil.
Langkah-langkah Analisis Data
- Hitung perubahan suhu (ΔT) dari suhu awal dan suhu akhir.
- Tentukan kapasitas kalor kalorimeter (Ccal) dari hasil kalibrasi.
- Hitung entalpi reaksi (ΔH) menggunakan persamaan ΔH =
C cal × ΔT.
Langkah-langkah Keselamatan
- Gunakan alat pelindung diri seperti sarung tangan, kacamata pengaman, dan jas lab.
- Berhati-hatilah saat menangani bahan kimia, terutama yang bersifat korosif atau beracun.
- Buang limbah reaksi sesuai dengan prosedur yang ditetapkan.
Ilustrasi Reaksi Termokimia
Untuk memahami konsep termokimia, ilustrasi atau diagram sangat membantu. Ilustrasi ini menunjukkan perubahan energi dalam reaksi kimia, membantu memvisualisasikan proses yang mendasarinya.
Dalam diagram reaksi termokimia, reaktan dan produk digambarkan sebagai garis horizontal, mewakili keadaan energi mereka. Panah menunjukkan arah reaksi, dan perubahan energi ditunjukkan oleh perbedaan ketinggian garis-garis ini.
Reaksi Eksotermik
Dalam reaksi eksotermik, energi dilepaskan ke lingkungan. Pada diagram, ini digambarkan sebagai panah yang menunjuk ke bawah dari garis reaktan ke garis produk. Perbedaan ketinggian antara garis-garis ini menunjukkan jumlah energi yang dilepaskan.
Reaksi Endotermik
Dalam reaksi endotermik, energi diserap dari lingkungan. Pada diagram, ini digambarkan sebagai panah yang menunjuk ke atas dari garis reaktan ke garis produk. Perbedaan ketinggian antara garis-garis ini menunjukkan jumlah energi yang diserap.
Ilustrasi reaksi termokimia ini memberikan pemahaman visual tentang perubahan energi yang terjadi dalam reaksi kimia, membuatnya lebih mudah untuk memahami konsep termokimia.
Terakhir
Dengan memahami prinsip-prinsip termokimia dan cara menyelesaikan soal-soal esainya, para pelajar dan praktisi dapat memperoleh wawasan yang lebih dalam tentang sifat energi dan peranannya dalam reaksi kimia. Pengetahuan ini memberdayakan para ilmuwan dan insinyur untuk merancang dan mengoptimalkan proses yang efisien secara energi, berkontribusi pada kemajuan teknologi dan keberlanjutan lingkungan.
Sudut Pertanyaan Umum (FAQ)
Apa itu reaksi endotermik?
Reaksi endotermik menyerap energi dari lingkungan, menyebabkan peningkatan suhu sistem.
Bagaimana cara menghitung entalpi reaksi?
Entalpi reaksi dapat dihitung menggunakan persamaan: ΔH = ΣH produk – ΣH reaktan , di mana H adalah entalpi molar.
Apa aplikasi termokimia dalam pengembangan obat?
Termokimia digunakan untuk mempelajari stabilitas obat, mengoptimalkan penyerapan dan pelepasan obat, serta merancang obat baru dengan sifat termodinamika yang diinginkan.