Asam dan basa merupakan konsep fundamental dalam kimia yang memainkan peran penting dalam berbagai aspek kehidupan kita. Teori asam basa telah berevolusi seiring waktu, dengan masing-masing teori memberikan pemahaman yang lebih komprehensif tentang sifat dan perilaku asam dan basa.
Praktikum asam basa sangat penting untuk memperkuat pemahaman teoritis dan mengembangkan keterampilan praktis yang penting dalam berbagai bidang, seperti kimia analitik, biokimia, dan farmasi.
Konsep Dasar Teori Asam Basa
Teori asam basa merupakan landasan untuk memahami sifat kimia dan perilaku asam, basa, dan larutannya. Beberapa teori utama yang menjelaskan konsep asam basa antara lain:
Teori Asam Basa Arrhenius
Teori Arrhenius mendefinisikan asam sebagai zat yang menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air, sedangkan basa menghasilkan ion hidroksida (OH-) dalam air.
Teori Asam Basa Bronsted-Lowry
Teori Bronsted-Lowry memperluas definisi asam dan basa dengan menyatakan bahwa asam adalah zat yang dapat menyumbangkan ion hidrogen, sedangkan basa adalah zat yang dapat menerima ion hidrogen.
Teori Asam Basa Lewis
Teori Lewis memberikan definisi yang lebih umum tentang asam dan basa. Asam adalah zat yang dapat menerima pasangan elektron, sedangkan basa adalah zat yang dapat menyumbangkan pasangan elektron.
Pengukuran Asam Basa

Pengukuran asam basa sangat penting dalam berbagai bidang, termasuk kimia, biologi, dan kedokteran. Berbagai metode digunakan untuk mengukur keasaman atau kebasaan suatu larutan.
Skala pH
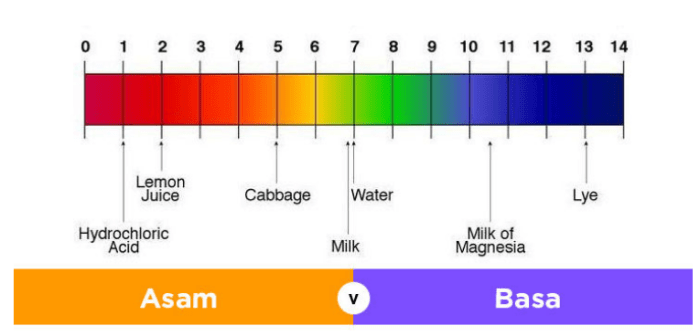
Skala pH adalah ukuran keasaman atau kebasaan larutan. Skala berkisar dari 0 hingga 14, dengan 7 sebagai titik netral. Larutan dengan pH kurang dari 7 bersifat asam, sedangkan larutan dengan pH lebih besar dari 7 bersifat basa.
Indikator Asam Basa
Indikator asam basa adalah zat yang berubah warna tergantung pada pH larutan. Mereka digunakan untuk menentukan apakah suatu larutan bersifat asam, basa, atau netral. Misalnya, kertas lakmus berubah menjadi merah pada larutan asam dan biru pada larutan basa.
Titrasi
Titrasi adalah metode untuk menentukan konsentrasi asam atau basa dalam suatu larutan. Larutan yang diketahui konsentrasinya (disebut titran) ditambahkan secara bertahap ke larutan yang tidak diketahui konsentrasinya (disebut analit). Titik akhir titrasi adalah ketika jumlah titran yang ditambahkan setara dengan jumlah analit dalam larutan.
Reaksi Asam Basa
Reaksi asam basa adalah reaksi kimia antara asam dan basa yang menghasilkan garam dan air. Reaksi ini penting dalam banyak proses kimia, termasuk pencernaan, netralisasi, dan pembuatan obat.
Reaksi Netralisasi
Reaksi netralisasi terjadi ketika asam dan basa bereaksi dalam jumlah ekivalen, menghasilkan garam dan air. Reaksi ini eksotermik, artinya melepaskan panas.
- Contoh: Reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH) menghasilkan natrium klorida (NaCl) dan air (H2O).
- HCl + NaOH → NaCl + H2O
Reaksi Hidrolisis Garam
Reaksi hidrolisis garam adalah reaksi antara garam dan air yang menghasilkan asam dan basa. Reaksi ini bergantung pada kekuatan asam dan basa yang dihasilkan.
- Contoh: Reaksi antara natrium asetat (CH3COONa) dan air menghasilkan asam asetat (CH3COOH) dan natrium hidroksida (NaOH).
- CH3COONa + H2O → CH3COOH + NaOH
Reaksi Asam-Basa dalam Larutan Penyangga
Larutan penyangga adalah larutan yang dapat menahan perubahan pH ketika asam atau basa ditambahkan. Larutan penyangga mengandung asam lemah dan basa konjugasinya atau basa lemah dan asam konjugasinya.
- Contoh: Larutan penyangga asam asetat/natrium asetat mengandung asam asetat lemah dan basa konjugasinya, natrium asetat.
- Ketika asam kuat ditambahkan ke larutan penyangga, asam lemah bereaksi dengan ion hidrogen untuk membentuk basa konjugasinya.
- Ketika basa kuat ditambahkan ke larutan penyangga, basa lemah bereaksi dengan ion hidroksida untuk membentuk asam konjugasinya.
Praktikum Asam Basa
Praktikum asam basa merupakan salah satu bagian penting dalam kimia yang mempelajari sifat-sifat asam dan basa serta reaksinya.
Praktikum ini mencakup berbagai metode untuk menentukan konsentrasi asam atau basa, mengukur pH larutan, dan menyelidiki sifat-sifat reaksi asam basa.
Langkah-langkah Praktikum Asam Basa
- Menyiapkan larutan asam dan basa dengan konsentrasi yang diketahui.
- Melakukan titrasi untuk menentukan konsentrasi asam atau basa yang tidak diketahui.
- Mengukur pH larutan asam atau basa menggunakan pH meter atau indikator.
- Menganalisis data dan menghitung konsentrasi atau pH yang tidak diketahui.
Prosedur Eksperimen Titrasi
Titrasi adalah metode yang digunakan untuk menentukan konsentrasi asam atau basa yang tidak diketahui dengan mereaksikannya dengan larutan asam atau basa dengan konsentrasi yang diketahui.
Berikut adalah langkah-langkah umum dalam prosedur titrasi:
- Pipet sejumlah volume larutan asam atau basa yang tidak diketahui ke dalam labu Erlenmeyer.
- Tambahkan beberapa tetes indikator ke dalam larutan.
- Isi buret dengan larutan asam atau basa dengan konsentrasi yang diketahui.
- Tambahkan larutan dari buret secara perlahan ke dalam larutan dalam labu Erlenmeyer sambil diaduk terus menerus.
- Titik akhir titrasi tercapai ketika warna indikator berubah.
- Catatan volume larutan yang ditambahkan dari buret.
Cara Menghitung pH Larutan
pH larutan adalah ukuran keasaman atau kebasaan larutan.
pH dapat dihitung menggunakan rumus berikut:
pH =
log[H+],
di mana [H+] adalah konsentrasi ion hidrogen dalam larutan.
Simpulan Akhir
Pemahaman dasar tentang teori dan praktikum asam basa sangat penting bagi siapa saja yang berkecimpung di bidang sains. Konsep-konsep ini membentuk dasar untuk penelitian dan pengembangan yang berkelanjutan di berbagai disiplin ilmu.
Pertanyaan Umum yang Sering Muncul
Apa perbedaan antara asam kuat dan asam lemah?
Asam kuat terdisosiasi sempurna dalam air, menghasilkan konsentrasi ion hidrogen yang tinggi, sedangkan asam lemah terdisosiasi sebagian, menghasilkan konsentrasi ion hidrogen yang lebih rendah.
Bagaimana cara menentukan pH larutan asam?
pH larutan asam dapat ditentukan menggunakan indikator asam basa atau pH meter. Indikator berubah warna pada rentang pH tertentu, sedangkan pH meter memberikan pengukuran pH yang lebih tepat.
Apa tujuan titrasi dalam praktikum asam basa?
Titrasi digunakan untuk menentukan konsentrasi asam atau basa dalam larutan yang tidak diketahui dengan mereaksikannya dengan larutan standar yang konsentrasinya diketahui.
