Sifat koligatif larutan memainkan peran penting dalam berbagai bidang sains dan kehidupan sehari-hari. Sifat-sifat ini dipengaruhi oleh jumlah partikel terlarut dalam larutan, bukan oleh sifat partikel tersebut. Memahami sifat koligatif dan hubungannya dengan komposisi larutan sangat penting untuk memprediksi perilaku larutan dan memanfaatkannya secara efektif.
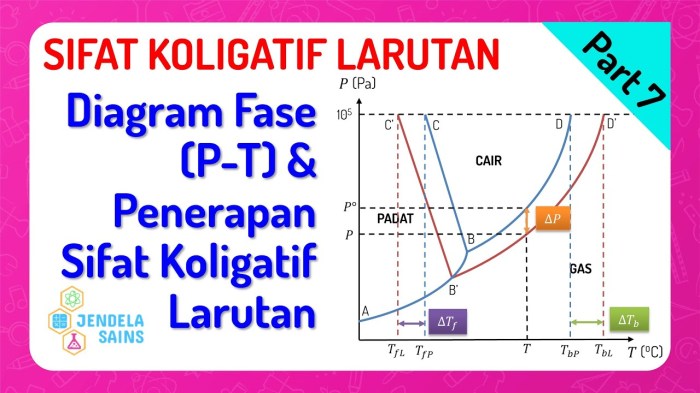
Diagram fasa larutan memberikan representasi grafis yang berharga tentang perilaku larutan pada berbagai kondisi suhu, tekanan, dan komposisi. Diagram ini memungkinkan para ilmuwan dan praktisi untuk memvisualisasikan dan memprediksi perubahan sifat koligatif larutan, seperti titik beku, titik didih, tekanan osmotik, dan penurunan tekanan uap.
Sifat Koligatif Larutan
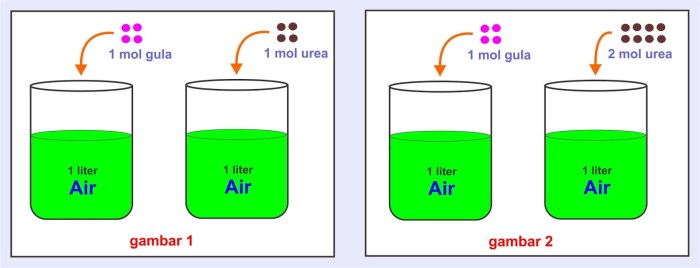
Sifat koligatif larutan adalah sifat-sifat yang bergantung pada jumlah partikel zat terlarut dalam suatu larutan, bukan pada jenis zat terlarutnya.
Sifat koligatif larutan yang umum meliputi:
- Penurunan tekanan uap
- Kenaikan titik didih
- Penurunan titik beku
- Tekanan osmotik
Penurunan Tekanan Uap
Penurunan tekanan uap larutan terjadi karena adanya partikel zat terlarut yang menempati ruang di atas permukaan larutan, sehingga mengurangi jumlah molekul pelarut yang dapat menguap.
Kenaikan Titik Didih
Kenaikan titik didih larutan terjadi karena adanya partikel zat terlarut yang mengganggu proses pembentukan ikatan antarmolekul pelarut, sehingga membutuhkan suhu yang lebih tinggi untuk memutuskan ikatan tersebut dan mencapai titik didih.
Penurunan Titik Beku
Penurunan titik beku larutan terjadi karena adanya partikel zat terlarut yang mengganggu proses pembentukan kristal pelarut, sehingga membutuhkan suhu yang lebih rendah untuk memulai proses kristalisasi dan mencapai titik beku.
Tekanan Osmotik
Tekanan osmotik adalah tekanan yang diperlukan untuk mencegah perpindahan pelarut dari larutan yang memiliki konsentrasi lebih rendah ke larutan yang memiliki konsentrasi lebih tinggi melalui membran semipermeabel.
Sifat koligatif larutan memiliki berbagai penerapan dalam kehidupan sehari-hari, seperti:
- Penambahan garam pada air untuk menurunkan titik bekunya sehingga mencegah pembentukan es pada jalan raya
- Penggunaan etilen glikol sebagai antibeku pada radiator mobil
- Pembuatan larutan intravena dengan konsentrasi yang sesuai untuk mencegah lisis atau krenasi sel darah merah
Diagram Fasa Larutan
Diagram fasa larutan adalah representasi grafis dari hubungan antara suhu, tekanan, dan komposisi larutan. Diagram ini memberikan wawasan tentang perilaku larutan di bawah berbagai kondisi.
Diagram fasa larutan dapat dibagi menjadi beberapa wilayah, yang mewakili fase berbeda dari larutan. Fase yang paling umum adalah fase cair, padat, dan gas. Garis pada diagram fasa menunjukkan batas antara fase yang berbeda.
- Konstruksi Diagram Fasa
Diagram fasa larutan dibuat dengan menentukan titik leleh dan titik didih larutan pada berbagai komposisi. Titik-titik ini kemudian diplot pada grafik, dan garis yang menghubungkan titik-titik tersebut membentuk batas fase.
- Aplikasi Diagram Fasa
Diagram fasa larutan dapat digunakan untuk memprediksi perilaku larutan di bawah berbagai kondisi. Misalnya, diagram fasa dapat digunakan untuk menentukan apakah larutan akan membeku pada suhu tertentu atau apakah larutan akan menguap pada tekanan tertentu.
Penurunan Titik Beku
Penurunan titik beku merupakan penurunan suhu beku larutan dibandingkan dengan pelarut murni. Hal ini terjadi karena adanya partikel terlarut dalam larutan yang mengganggu pembentukan kristal pelarut.
Hubungan antara konsentrasi larutan dan penurunan titik beku dinyatakan dalam rumus berikut:
ΔTb = Kb × m
di mana:
- ΔTb adalah penurunan titik beku
- Kb adalah tetapan penurunan titik beku pelarut
- m adalah molalitas larutan
Konsentrasi dan Penurunan Titik Beku
Konsentrasi larutan berbanding lurus dengan penurunan titik beku. Semakin tinggi konsentrasi larutan, semakin besar penurunan titik bekunya.
| Konsentrasi (mol/kg) | Penurunan Titik Beku (°C) |
|---|---|
| 0,1 | -0,51 |
| 0,2 | -1,02 |
| 0,3 | -1,53 |
Kenaikan Titik Didih

Kenaikan titik didih adalah peningkatan suhu titik didih suatu larutan dibandingkan dengan titik didih pelarut murninya. Semakin tinggi konsentrasi zat terlarut dalam larutan, semakin tinggi kenaikan titik didihnya.
Kenaikan titik didih suatu larutan dapat dihitung menggunakan rumus berikut:
ΔTb = Kb x m
di mana:* ΔTb adalah kenaikan titik didih
- Kb adalah tetapan kenaikan titik didih pelarut
- m adalah molalitas larutan (mol zat terlarut per kg pelarut)
Tekanan Osmotik
Tekanan osmotik adalah gaya yang diterapkan pada suatu larutan untuk mencegah masuknya pelarut ke larutan melalui membran semipermeabel. Membran semipermeabel memungkinkan pelarut, seperti air, melewatinya tetapi menghalangi zat terlarut.
Rumus Tekanan Osmotik
Tekanan osmotik dapat dihitung menggunakan rumus berikut:
π = MRT
Dimana:
- π adalah tekanan osmotik (dalam pascal)
- M adalah molaritas larutan (dalam mol/liter)
- R adalah konstanta gas ideal (8,314 J/mol K)
- T adalah suhu (dalam Kelvin)
Pengaruh Tekanan Osmotik pada Sel
Tekanan osmotik memainkan peran penting dalam sel hidup. Ketika sel ditempatkan dalam larutan yang memiliki tekanan osmotik lebih rendah dari sel, air akan masuk ke dalam sel melalui osmosis, menyebabkan sel mengembang dan berpotensi pecah (lisis). Sebaliknya, jika sel ditempatkan dalam larutan yang memiliki tekanan osmotik lebih tinggi dari sel, air akan keluar dari sel, menyebabkan sel mengerut (krenasi).
Tekanan osmotik penting untuk mempertahankan keseimbangan air dalam sel dan menjaga bentuk dan fungsi sel yang tepat.
Penurunan Tekanan Uap
Penurunan tekanan uap merupakan salah satu sifat koligatif larutan yang dipengaruhi oleh konsentrasi zat terlarut.
Hubungan Konsentrasi Larutan dan Penurunan Tekanan Uap
Penurunan tekanan uap berbanding lurus dengan konsentrasi zat terlarut. Semakin tinggi konsentrasi zat terlarut, semakin besar penurunan tekanan uap larutan.
Rumus Penurunan Tekanan Uap
Penurunan tekanan uap dapat dihitung menggunakan rumus berikut:
ΔP = P o
P
di mana:* ΔP adalah penurunan tekanan uap
- Po adalah tekanan uap pelarut murni
- P adalah tekanan uap larutan
Diagram Penurunan Tekanan Uap
Hubungan antara konsentrasi larutan dan penurunan tekanan uap dapat digambarkan dalam sebuah diagram. Diagram tersebut menunjukkan bahwa penurunan tekanan uap meningkat secara linier seiring dengan bertambahnya konsentrasi zat terlarut.
Kesimpulan

Sifat koligatif larutan dan diagram fasa larutan adalah alat yang ampuh untuk memahami dan mengendalikan perilaku larutan. Dengan memanfaatkan prinsip-prinsip ini, kita dapat mengembangkan aplikasi baru dalam berbagai bidang, termasuk kimia, biologi, dan farmasi. Dari penurunan titik beku dalam antibeku hingga tekanan osmotik dalam sel hidup, sifat koligatif larutan terus membentuk dunia kita.
Pertanyaan Umum (FAQ)
Apa perbedaan antara sifat koligatif dan sifat non-koligatif larutan?
Sifat koligatif bergantung pada konsentrasi partikel terlarut, sedangkan sifat non-koligatif bergantung pada sifat partikel terlarut dan pelarut.
Bagaimana diagram fasa digunakan untuk memprediksi perilaku larutan?
Diagram fasa menunjukkan wilayah di mana larutan ada dalam fase padat, cair, atau gas. Hal ini memungkinkan prediksi perubahan fase berdasarkan perubahan suhu dan komposisi.
Apa aplikasi praktis sifat koligatif larutan?
Sifat koligatif digunakan dalam berbagai aplikasi, seperti antibeku (penurunan titik beku), pencairan es jalan (penurunan titik beku), dan dialisis (tekanan osmotik).