Dunia kita digerakkan oleh reaksi kimia yang tak terhitung jumlahnya. Reaksi ini merupakan proses di mana zat-zat berubah menjadi zat baru, membentuk dasar bagi semua proses kehidupan dan teknologi modern. Dalam artikel ini, kita akan menelusuri beberapa reaksi kimia yang paling umum diketahui, sifat-sifatnya, dan aplikasinya.
Dari reaksi pembakaran yang menggerakkan mobil kita hingga reaksi fotosintesis yang menyokong kehidupan di Bumi, reaksi kimia memiliki peran penting dalam membentuk dunia kita. Memahami reaksi ini sangat penting untuk kemajuan ilmiah dan teknologi.
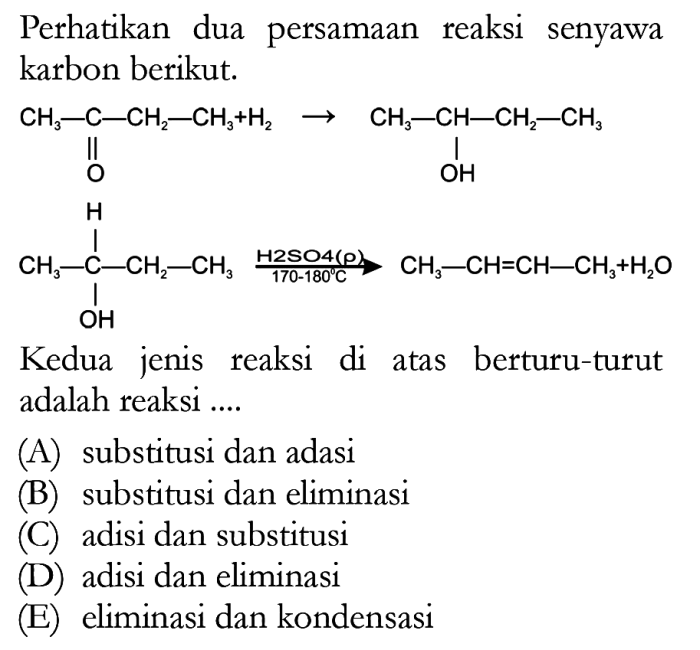
Reaksi Kimia
Reaksi kimia adalah proses perubahan kimia yang melibatkan pemutusan ikatan kimia pada reaktan dan pembentukan ikatan kimia baru pada produk. Reaksi ini dapat berupa reaksi sederhana atau kompleks, dan dapat terjadi dalam berbagai kondisi.
Beberapa faktor yang memengaruhi jalannya reaksi kimia meliputi:
- Konsentrasi reaktan
- Suhu
- Tekanan
- Katalis
Persamaan Reaksi Kimia
Persamaan reaksi kimia digunakan untuk mewakili reaksi kimia secara simbolis. Persamaan ini menunjukkan reaktan, produk, dan koefisien stoikiometri yang menyeimbangkan persamaan. Misalnya, reaksi pembakaran metana dapat ditulis sebagai berikut:
CH 4 + 2O 2 → CO 2 + 2H 2 O
Sifat Reaksi

Reaksi kimia menunjukkan karakteristik unik yang memengaruhi jalannya reaksi dan menentukan hasilnya. Sifat-sifat ini meliputi jenis reaksi, kecepatan reaksi, dan arah reaksi.
Jenis Reaksi
Reaksi kimia dapat diklasifikasikan ke dalam beberapa jenis berdasarkan perubahan kimia yang terjadi, seperti:
Reaksi sintesis (kombinasi)
Dua atau lebih zat bereaksi membentuk zat baru yang lebih kompleks.
Reaksi dekomposisi
Satu zat terurai menjadi dua atau lebih zat yang lebih sederhana.
Reaksi perpindahan tunggal
Satu unsur menggantikan unsur lain dalam suatu senyawa.
Reaksi perpindahan ganda
Dua senyawa bertukar ion untuk membentuk dua senyawa baru.
Kecepatan Reaksi
Kecepatan reaksi mengacu pada laju terjadinya reaksi kimia. Faktor-faktor yang memengaruhi kecepatan reaksi meliputi konsentrasi reaktan, suhu, luas permukaan, dan katalis.
Arah Reaksi
Arah reaksi menentukan apakah reaksi berlangsung ke arah pembentukan produk (reaksi eksotermik) atau pemecahan produk (reaksi endotermik). Reaksi eksotermik melepaskan panas, sedangkan reaksi endotermik menyerap panas dari lingkungan.Hubungan antara sifat reaksi dan faktor-faktor yang memengaruhi jalannya reaksi sangat penting dalam memahami dan memprediksi perilaku reaksi kimia.
Pengetahuan ini diterapkan dalam berbagai bidang, seperti industri kimia, obat-obatan, dan penelitian ilmiah.
Aplikasi Reaksi
Reaksi kimia yang diketahui memiliki berbagai aplikasi praktis di berbagai bidang, termasuk industri, kedokteran, dan penelitian ilmiah.
Aplikasi Industri
*
-*Pembuatan Bahan Kimia
Reaksi kimia digunakan untuk memproduksi berbagai bahan kimia industri, seperti asam sulfat, amonia, dan plastik.
-
-*Pemurnian Minyak
Reaksi kimia digunakan untuk memurnikan minyak mentah dan menghilangkan kotoran.
-*Pengolahan Air
Reaksi kimia digunakan untuk mengolah air dan menghilangkan polutan.
Aplikasi Medis
*
-*Produksi Obat-obatan
Reaksi kimia digunakan untuk memproduksi berbagai obat-obatan, seperti antibiotik, obat anti-inflamasi, dan obat antikanker.
-
-*Diagnosis Medis
Reaksi kimia digunakan dalam tes diagnostik, seperti tes darah dan tes urin.
-*Terapi Medis
Reaksi kimia digunakan dalam terapi medis, seperti kemoterapi dan radioterapi.
Aplikasi Penelitian Ilmiah
*
-*Penelitian Kimia
Reaksi kimia digunakan untuk mempelajari sifat dan perilaku bahan kimia.
-
-*Penelitian Biokimia
Reaksi kimia digunakan untuk mempelajari proses biokimia dalam sel hidup.
-*Penelitian Material
Reaksi kimia digunakan untuk mengembangkan dan mengkarakterisasi material baru.
Potensi Aplikasi Baru
Penelitian berkelanjutan mengungkap aplikasi baru dari reaksi kimia yang diketahui. Beberapa potensi aplikasi baru meliputi:*
-*Energi Berkelanjutan
Reaksi kimia dapat digunakan untuk menghasilkan bahan bakar bersih dan sumber energi terbarukan.
-
-*Pengobatan Penyakit
Reaksi kimia dapat digunakan untuk mengembangkan pengobatan baru untuk penyakit kronis, seperti kanker dan penyakit jantung.
-*Nanoteknologi
Reaksi kimia dapat digunakan untuk membuat bahan dan perangkat dalam skala nano dengan sifat unik.
Studi Lebih Lanjut

Studi lebih lanjut tentang reaksi kimia yang diketahui sangat penting untuk memajukan pemahaman kita tentang sifat dan perilaku reaksi ini.
Penelitian lanjutan dapat mengarah pada penemuan mekanisme reaksi baru, pengoptimalan kondisi reaksi, dan pengembangan aplikasi praktis baru.
Metode Eksperimental dan Komputasi
Metode eksperimental dan komputasi dapat digunakan untuk menyelidiki reaksi kimia yang diketahui lebih lanjut. Metode eksperimental meliputi spektroskopi, kalorimetri, dan elektrokimia. Metode komputasi meliputi pemodelan molekuler, teori fungsi rapat, dan dinamika molekuler.
Implikasi Potensial
Penelitian lebih lanjut tentang reaksi kimia yang diketahui dapat memiliki implikasi yang signifikan bagi pemahaman kita tentang reaksi kimia. Implikasi ini meliputi:
- Pemahaman yang lebih baik tentang mekanisme reaksi
- Pengembangan katalis dan reagen baru
- Perbaikan proses kimia industri
- Penemuan aplikasi baru dalam bidang farmasi, bahan, dan energi
Tabel Reaksi Kimia
Tabel berikut merangkum reaksi kimia yang diketahui, termasuk persamaan reaksi, jenis reaksi, dan sifat-sifat relevan lainnya:
| Persamaan Reaksi | Jenis Reaksi | Sifat |
|---|---|---|
| 2H2 + O2 → 2H2O | Pembakaran | Eksotermik, menghasilkan air |
| CaCO3 + 2HCl → CaCl2 + H2O + CO2 | Dekomposisi | Endotermik, menghasilkan karbon dioksida |
| 2NaOH + H2SO4 → Na2SO4 + 2H2O | Netralisasi | Eksotermik, menghasilkan garam |
| Fe + 2HCl → FeCl2 + H2 | Redoks | Eksotermik, menghasilkan hidrogen |
| CH4 + 2O2 → CO2 + 2H2O | Pembakaran lengkap | Eksotermik, menghasilkan karbon dioksida dan air |
Blok Kutipan Contoh Reaksi

Blok kutipan berikut menyajikan contoh spesifik reaksi kimia yang diketahui, menguraikan konteks dan signifikansi reaksi tersebut, serta mendiskusikan kontribusinya pada pemahaman kita tentang reaksi kimia secara keseluruhan.
Contoh Reaksi Pembakaran
- Pembakaran metana: CH4 + 2O2 → CO2 + 2H2O
- Pembakaran propana: C3H8 + 5O2 → 3CO2 + 4H2O
Reaksi pembakaran adalah contoh klasik reaksi eksotermik, yang melepaskan panas. Reaksi ini penting dalam banyak proses industri dan domestik, seperti pembangkit listrik dan pemanas.
Contoh Reaksi Sintesis
- Sintesis air: 2H2 + O2 → 2H2O
- Sintesis amonia: N2 + 3H2 → 2NH3
Reaksi sintesis melibatkan penggabungan dua atau lebih zat untuk membentuk zat baru. Reaksi ini penting dalam produksi bahan kimia dan pupuk.
Contoh Reaksi Dekomposisi
- Dekomposisi air: 2H2O → 2H2 + O2
- Dekomposisi kalsium karbonat: CaCO3 → CaO + CO2
Reaksi dekomposisi melibatkan pemecahan suatu zat menjadi dua atau lebih zat yang lebih sederhana. Reaksi ini penting dalam proses seperti produksi logam dan ekstraksi gas.
Ringkasan Akhir
Studi tentang reaksi kimia terus berkembang, membuka jalan bagi penemuan dan aplikasi baru. Dari pengembangan obat-obatan baru hingga pengembangan bahan canggih, reaksi kimia memiliki potensi untuk membentuk masa depan kita. Dengan meneliti dan memahami reaksi-reaksi ini lebih lanjut, kita dapat memanfaatkan kekuatannya untuk memecahkan tantangan dan memajukan peradaban manusia.
Sudut Pertanyaan Umum (FAQ)
Apa itu reaksi kimia?
Reaksi kimia adalah proses di mana zat-zat berinteraksi dan berubah menjadi zat baru dengan sifat yang berbeda.
Apa faktor yang mempengaruhi jalannya reaksi kimia?
Faktor-faktor seperti konsentrasi reaktan, suhu, katalis, dan tekanan dapat mempengaruhi laju dan arah reaksi kimia.
Sebutkan contoh reaksi kimia yang diketahui.
Pembakaran, fotosintesis, respirasi seluler, dan reaksi asam-basa adalah beberapa contoh reaksi kimia yang diketahui.
Bagaimana reaksi kimia digunakan dalam aplikasi praktis?
Reaksi kimia digunakan dalam berbagai aplikasi, termasuk produksi bahan bakar, pembuatan obat-obatan, pengolahan makanan, dan teknologi energi.
Apa area penelitian lebih lanjut yang terkait dengan reaksi kimia?
Area penelitian lebih lanjut meliputi pengembangan reaksi kimia baru, studi tentang mekanisme reaksi, dan aplikasi reaksi kimia dalam bidang-bidang baru.
