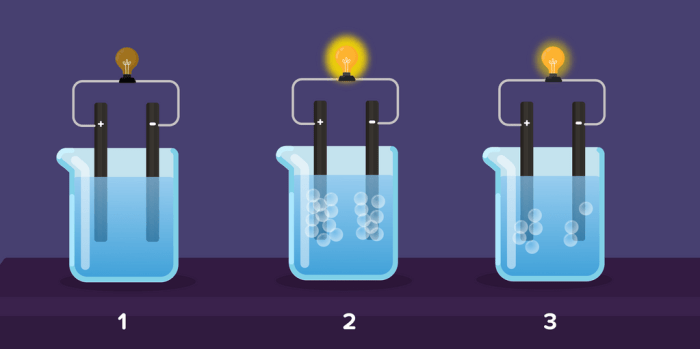
Gambar larutan elektrolit dan non elektrolit – Dalam kimia, larutan dapat diklasifikasikan menjadi dua jenis utama: larutan elektrolit dan non elektrolit. Perbedaan mendasar antara kedua jenis larutan ini terletak pada kemampuannya menghantarkan listrik.
Larutan elektrolit adalah larutan yang mengandung ion-ion bebas, sehingga dapat menghantarkan listrik. Sementara itu, larutan non elektrolit tidak mengandung ion-ion bebas, sehingga tidak dapat menghantarkan listrik.
Sifat Fisik Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit dan non elektrolit menunjukkan sifat fisik yang berbeda karena perbedaan dalam komposisi dan sifat kimiawi.
Larutan elektrolit mengandung ion-ion yang bergerak bebas, sedangkan larutan non elektrolit tidak.
Sifat Elektrik
- Larutan Elektrolit: Dapat menghantarkan arus listrik karena adanya ion yang dapat bergerak bebas.
- Larutan Non Elektrolit: Tidak dapat menghantarkan arus listrik karena tidak mengandung ion yang dapat bergerak bebas.
Titik Didih dan Titik Beku, Gambar larutan elektrolit dan non elektrolit
- Larutan Elektrolit: Memiliki titik didih yang lebih tinggi dan titik beku yang lebih rendah dibandingkan pelarut murninya karena adanya ion yang terlarut.
- Larutan Non Elektrolit: Memiliki titik didih dan titik beku yang hampir sama dengan pelarut murninya.
Sifat Osmotik
- Larutan Elektrolit: Menunjukkan tekanan osmotik yang lebih tinggi dibandingkan larutan non elektrolit dengan konsentrasi yang sama karena adanya ion yang lebih banyak.
- Larutan Non Elektrolit: Menunjukkan tekanan osmotik yang lebih rendah dibandingkan larutan elektrolit dengan konsentrasi yang sama.
Contoh
| Jenis Larutan | Contoh | Sifat |
|---|---|---|
| Elektrolit | NaCl (garam dapur) | Dapat menghantarkan arus listrik, titik didih tinggi, titik beku rendah, tekanan osmotik tinggi |
| Non Elektrolit | Gula | Tidak dapat menghantarkan arus listrik, titik didih dan titik beku hampir sama dengan pelarut murni, tekanan osmotik rendah |
Konduktivitas Listrik Larutan Elektrolit dan Non Elektrolit
Konduktivitas listrik adalah kemampuan suatu larutan untuk menghantarkan arus listrik. Larutan elektrolit adalah larutan yang mengandung ion-ion bebas, yang memungkinkan larutan tersebut menghantarkan listrik, sedangkan larutan non elektrolit tidak mengandung ion-ion bebas, sehingga tidak dapat menghantarkan listrik.
Perbedaan Konduktivitas Listrik
Perbedaan konduktivitas listrik antara larutan elektrolit dan non elektrolit disebabkan oleh keberadaan ion-ion bebas. Ion-ion bebas adalah atom atau molekul yang telah kehilangan atau memperoleh elektron, sehingga memiliki muatan listrik. Dalam larutan elektrolit, ion-ion bebas bergerak bebas, sehingga dapat menghantarkan arus listrik.
Gambar larutan elektrolit dan non elektrolit dapat memberikan wawasan tentang perilaku ionik mereka. Untuk memahami konsep ini secara lebih mendalam, pemahaman tentang rumus bilangan berpangkat dan bentuk akar sangat penting. Rumus-rumus ini memungkinkan perhitungan konsentrasi ion dalam larutan, yang pada gilirannya menentukan sifat konduktivitasnya.
Dengan menggabungkan pengetahuan tentang rumus bilangan berpangkat dan bentuk akar dengan pengamatan gambar larutan elektrolit dan non elektrolit, kita dapat memperoleh pemahaman yang komprehensif tentang sifat larutan ini.
Sebaliknya, dalam larutan non elektrolit, tidak terdapat ion-ion bebas. Molekul-molekul dalam larutan non elektrolit tetap netral, sehingga tidak dapat menghantarkan arus listrik.
Jenis-Jenis Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan listrik karena adanya ion-ion yang bergerak bebas di dalamnya. Larutan elektrolit dapat diklasifikasikan menjadi tiga jenis berdasarkan kekuatan elektrolitnya, yaitu elektrolit kuat, elektrolit lemah, dan non elektrolit.
Elektrolit Kuat
Elektrolit kuat adalah larutan yang terionisasi sempurna dalam air, menghasilkan konsentrasi ion yang tinggi. Ketika dilarutkan dalam air, elektrolit kuat akan terurai menjadi ion-ion penyusunnya secara lengkap. Contoh elektrolit kuat antara lain:
- Asam kuat (misalnya HCl, H 2SO 4)
- Basa kuat (misalnya NaOH, KOH)
- Garam yang larut (misalnya NaCl, KCl)
Elektrolit Lemah
Elektrolit lemah adalah larutan yang terionisasi sebagian dalam air, menghasilkan konsentrasi ion yang lebih rendah dibandingkan dengan elektrolit kuat. Ketika dilarutkan dalam air, elektrolit lemah hanya terurai sebagian menjadi ion-ion penyusunnya. Contoh elektrolit lemah antara lain:
- Asam lemah (misalnya CH 3COOH, HNO 2)
- Basa lemah (misalnya NH 4OH, CH 3NH 2)
Non Elektrolit
Non elektrolit adalah larutan yang tidak terionisasi dalam air, sehingga tidak dapat menghantarkan listrik. Ketika dilarutkan dalam air, non elektrolit tetap dalam bentuk molekul atau senyawa yang tidak terurai menjadi ion-ion. Contoh non elektrolit antara lain:
- Gula (misalnya sukrosa, glukosa)
- Alkohol (misalnya etanol, metanol)
- Senyawa organik (misalnya benzena, aseton)
Proses Ionisasi Larutan Elektrolit
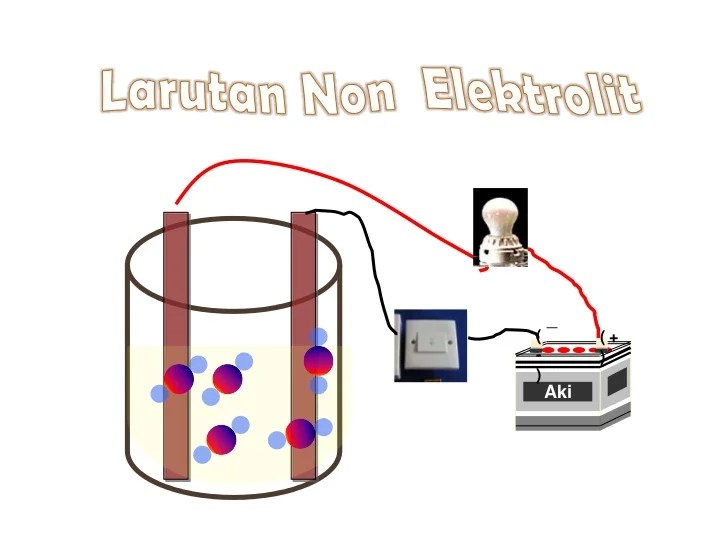
Proses ionisasi terjadi ketika suatu senyawa elektrolit dilarutkan dalam pelarut polar, seperti air. Selama proses ini, molekul elektrolit terpecah menjadi ion-ion penyusunnya, menghasilkan larutan yang dapat menghantarkan listrik.
Pemisahan Ion
Proses ionisasi melibatkan pemisahan ion positif (kation) dan ion negatif (anion) dari molekul elektrolit. Ion-ion ini dikelilingi oleh molekul pelarut, membentuk ion terhidrasi.
Faktor yang Mempengaruhi Ionisasi
Tingkat ionisasi suatu larutan elektrolit dipengaruhi oleh beberapa faktor, termasuk:* Sifat elektrolit: Elektrolit kuat terionisasi hampir sempurna dalam air, sedangkan elektrolit lemah hanya terionisasi sebagian.
Konsentrasi larutan
Semakin tinggi konsentrasi larutan, semakin tinggi tingkat ionisasinya.
Dalam studi tentang larutan elektrolit dan non elektrolit, para ilmuwan mengamati sifat listrik yang berbeda dari kedua jenis larutan ini. Untuk memahami konsep bilangan yang jumlahnya tertentu, seperti dua bilangan berikut yang jumlahnya 8 adalah , dapat membantu dalam menganalisis konsentrasi ion dalam larutan.
Dengan mengidentifikasi bilangan-bilangan yang jumlahnya sama dengan jumlah ion dalam larutan, peneliti dapat menentukan apakah larutan tersebut bersifat elektrolit atau non elektrolit.
Suhu
Suhu yang lebih tinggi meningkatkan ionisasi karena meningkatkan energi kinetik molekul.
Konsekuensi Ionisasi
Ionisasi larutan elektrolit memiliki beberapa konsekuensi penting, antara lain:* Konduktivitas listrik: Larutan elektrolit dapat menghantarkan listrik karena adanya ion-ion yang dapat bergerak bebas.
Tekanan osmotik
Ion-ion dalam larutan elektrolit berkontribusi terhadap tekanan osmotik, yang dapat mempengaruhi keseimbangan cairan dalam sistem biologis.
Reaktivitas kimia
Ion-ion yang dihasilkan dari ionisasi dapat bereaksi dengan zat lain dalam larutan, menyebabkan perubahan kimia.
Aplikasi Larutan Elektrolit dan Non Elektrolit
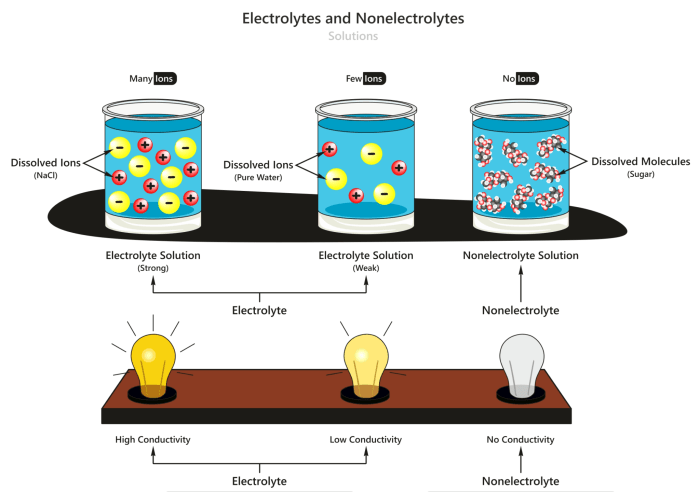
Larutan elektrolit dan non elektrolit memiliki berbagai aplikasi penting dalam kehidupan sehari-hari dan berbagai bidang industri. Memahami sifat dan perbedaannya sangat penting untuk memanfaatkan aplikasi ini secara efektif.
Aplikasi Larutan Elektrolit
- Baterai:Larutan elektrolit berfungsi sebagai penghantar ionik dalam baterai, memungkinkan aliran elektron dan menghasilkan arus listrik.
- Elektroplating:Larutan elektrolit digunakan untuk melapisi logam dengan logam lain melalui proses elektrokimia.
- Pengolahan Air:Elektrolisis menggunakan larutan elektrolit untuk menghilangkan kotoran dari air.
- Produksi Hidrogen:Elektrolisis air menggunakan larutan elektrolit untuk menghasilkan hidrogen, bahan bakar alternatif yang bersih.
- Medis:Larutan elektrolit, seperti cairan infus, digunakan untuk menggantikan cairan tubuh yang hilang dan menjaga keseimbangan elektrolit.
Aplikasi Larutan Non Elektrolit
- Pendingin:Larutan non elektrolit, seperti etilen glikol, digunakan sebagai antibeku dalam sistem pendingin.
- Pelarut:Larutan non elektrolit digunakan sebagai pelarut dalam berbagai industri, seperti industri farmasi, kimia, dan makanan.
- Pembersih:Larutan non elektrolit, seperti alkohol, digunakan sebagai pembersih dan disinfektan karena kemampuannya untuk melarutkan zat non polar.
- Lubrikan:Larutan non elektrolit, seperti minyak mineral, digunakan sebagai lubrikan untuk mengurangi gesekan antara permukaan yang bergerak.
- Medis:Larutan non elektrolit, seperti larutan glukosa, digunakan sebagai cairan infus untuk memberikan nutrisi dan energi.
Contoh-Contoh Larutan Elektrolit dan Non Elektrolit: Gambar Larutan Elektrolit Dan Non Elektrolit

Larutan elektrolit dan non elektrolit dapat dibedakan berdasarkan kemampuannya menghantarkan arus listrik. Larutan elektrolit mengandung ion-ion bebas yang memungkinkan arus listrik mengalir, sedangkan larutan non elektrolit tidak mengandung ion-ion bebas sehingga tidak dapat menghantarkan arus listrik.
Dalam larutan elektrolit, ion-ion terlarut memungkinkan aliran listrik, sedangkan pada larutan non elektrolit tidak. Batuan yang mempunyai nilai ekonomi tinggi, seperti batuan mulia , merupakan sumber mineral berharga yang banyak digunakan dalam industri perhiasan dan teknologi. Menariknya, gambar larutan elektrolit dan non elektrolit juga dapat memberikan informasi tentang struktur dan sifat batuan.
Melalui analisis gambar ini, para ahli geologi dapat mengidentifikasi komposisi mineral dan sifat listrik batuan, memberikan wawasan berharga tentang nilai ekonominya.
Larutan Elektrolit
Beberapa contoh larutan elektrolit meliputi:
- Larutan garam, seperti NaCl (natrium klorida) atau KCl (kalium klorida)
- Larutan basa, seperti NaOH (natrium hidroksida) atau KOH (kalium hidroksida)
- Larutan asam, seperti HCl (asam klorida) atau H 2SO 4(asam sulfat)
Larutan Non Elektrolit
Beberapa contoh larutan non elektrolit meliputi:
- Larutan gula, seperti sukrosa (C 12H 22O 11) atau glukosa (C 6H 12O 6)
- Larutan alkohol, seperti etanol (C 2H 5OH) atau metanol (CH 3OH)
- Larutan minyak, seperti minyak tanah atau minyak zaitun
Cara Membedakan Larutan Elektrolit dan Non Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik, sedangkan larutan non elektrolit tidak dapat menghantarkan arus listrik. Sifat ini disebabkan oleh adanya ion dalam larutan elektrolit.
Ada beberapa cara untuk membedakan larutan elektrolit dan non elektrolit, salah satunya adalah dengan menggunakan pengujian sederhana. Berikut adalah langkah-langkah pengujian dan interpretasi hasilnya:
Langkah Pengujian
- Siapkan dua larutan, satu larutan elektrolit dan satu larutan non elektrolit.
- Masukkan elektroda ke dalam masing-masing larutan.
- Hubungkan elektroda ke sumber listrik.
- Amati apakah ada arus listrik yang mengalir.
Interpretasi Hasil
- Jika ada arus listrik yang mengalir, maka larutan tersebut adalah larutan elektrolit.
- Jika tidak ada arus listrik yang mengalir, maka larutan tersebut adalah larutan non elektrolit.
Ringkasan Terakhir
Pemahaman tentang perbedaan antara larutan elektrolit dan non elektrolit sangat penting dalam berbagai bidang aplikasi, seperti elektrokimia, baterai, dan proses industri lainnya.
Ringkasan FAQ
Apa itu larutan elektrolit?
Larutan elektrolit adalah larutan yang mengandung ion-ion bebas, sehingga dapat menghantarkan listrik.
Apa perbedaan antara larutan elektrolit dan non elektrolit?
Perbedaan utama antara larutan elektrolit dan non elektrolit terletak pada kemampuannya menghantarkan listrik. Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion bebas, sedangkan larutan non elektrolit tidak dapat menghantarkan listrik karena tidak mengandung ion-ion bebas.