Sel volta, juga dikenal sebagai sel galvani, adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik melalui reaksi redoks spontan. Memahami gambar dan penjelasannya sangat penting untuk mengungkap prinsip dasar yang mendasari proses ini dan aplikasinya yang luas.
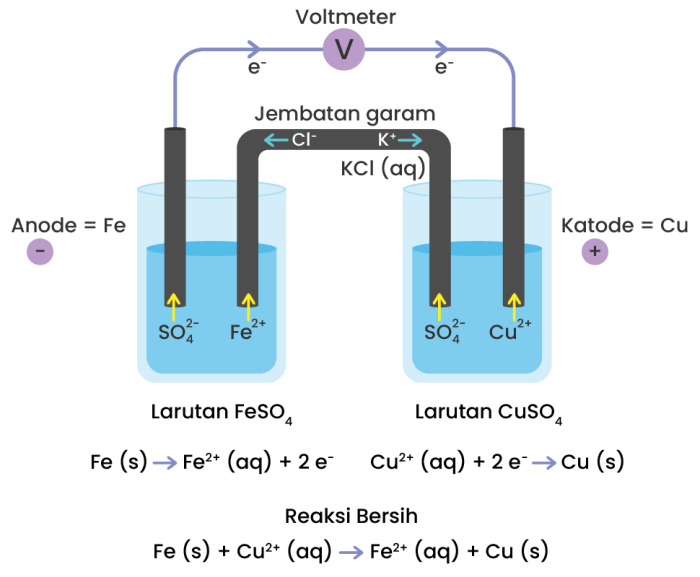
Gambar sel volta menunjukkan komponen utamanya, yaitu anoda, katoda, elektrolit, dan jembatan garam. Anoda dan katoda merupakan elektroda yang bereaksi, sedangkan elektrolit menyediakan ion untuk menjaga netralitas listrik dan jembatan garam memungkinkan perpindahan ion.
Gambar Sel Volta
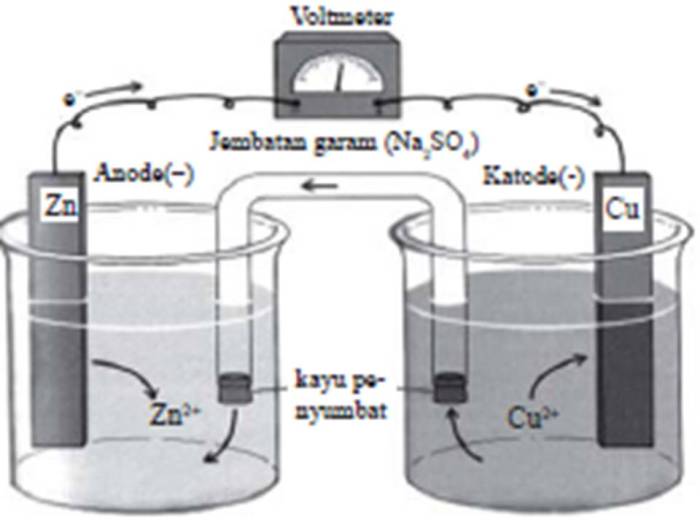
Komponen Sel Volta
- Anoda: Elektroda tempat terjadi oksidasi (pelepasan elektron).
- Katoda: Elektroda tempat terjadi reduksi (penerimaan elektron).
- Elektrolit: Larutan atau lelehan yang mengandung ion yang dapat bergerak bebas.
- Jembatan Garam: Tabung berisi larutan elektrolit yang menghubungkan kedua larutan setengah sel, memungkinkan ion bergerak untuk menjaga netralitas listrik.
Ilustrasi Sel Volta:
Aliran Elektron dan Ion:
- Elektron mengalir dari anoda ke katoda melalui kawat eksternal.
- Kation (ion positif) bergerak melalui jembatan garam dari larutan setengah sel anoda ke larutan setengah sel katoda.
- Anion (ion negatif) bergerak melalui jembatan garam dari larutan setengah sel katoda ke larutan setengah sel anoda.
Reaksi Kimia dalam Sel Volta
Reaksi kimia yang terjadi dalam sel volta melibatkan proses redoks, yaitu reaksi yang melibatkan transfer elektron. Pada sel volta, terjadi reaksi redoks spontan yang menghasilkan aliran arus listrik.
Reaksi Redoks di Anoda
Anoda adalah elektroda tempat terjadi reaksi oksidasi. Pada anoda, logam atau senyawa yang dioksidasi melepaskan elektron ke elektroda.
Reaksi Redoks di Katoda
Katoda adalah elektroda tempat terjadi reaksi reduksi. Pada katoda, ion logam atau senyawa lainnya menerima elektron dari elektroda dan mengalami reduksi.
Persamaan Reaksi Keseluruhan
Persamaan reaksi keseluruhan untuk sel volta merupakan penjumlahan reaksi redoks yang terjadi di anoda dan katoda. Persamaan ini menunjukkan transfer elektron dan menghasilkan arus listrik.
Peran Elektrolit
Elektrolit adalah larutan atau lelehan yang mengandung ion-ion. Elektrolit menyediakan jalur bagi ion-ion untuk bergerak antara anoda dan katoda, melengkapi rangkaian listrik.
Potensial Sel Volta
Potensial sel volta adalah perbedaan potensial antara dua elektroda dalam sel volta, yang merupakan perangkat elektrokimia yang menghasilkan arus listrik dari reaksi kimia spontan. Potensial sel diukur menggunakan voltmeter dan dinyatakan dalam volt (V).
Persamaan Nernst
Persamaan Nernst adalah persamaan yang digunakan untuk menghitung potensial sel pada kondisi non-standar. Persamaan ini menyatakan bahwa:“`E = E°
- (RT/nF)
- ln(Q)
“`di mana:* E adalah potensial sel pada kondisi non-standar
- E° adalah potensial sel standar
- R adalah konstanta gas (8,314 J/mol K)
- T adalah suhu dalam Kelvin
- n adalah jumlah elektron yang ditransfer dalam reaksi redoks
- F adalah konstanta Faraday (96.485 C/mol)
- Q adalah hasil bagi konsentrasi reaktan dan produk pada kondisi non-standar
Faktor-faktor yang Mempengaruhi Potensial SelPotensial sel dipengaruhi oleh beberapa faktor, antara lain:*
-*Konsentrasi reaktan dan produk
Semakin tinggi konsentrasi reaktan, semakin besar potensial sel.
-
-*Suhu
Semakin tinggi suhu, semakin kecil potensial sel.
-*Jenis elektroda
Bahan elektroda dapat mempengaruhi potensial sel.
-*Luas permukaan elektroda
Semakin besar luas permukaan elektroda, semakin besar potensial sel.
Tabel Potensial Sel Standar
Tabel berikut menyajikan nilai potensial sel standar untuk berbagai reaksi redoks:| Reaksi Redoks | E° (V) ||—|—|| Zn + Cu²⁺ → Zn²⁺ + Cu | 1,10 || Fe + Cu²⁺ → Fe²⁺ + Cu | 0,76 || Ag + Cu²⁺ → Ag⁺ + Cu | 0,46 || Au + Cu²⁺ → Au³⁺ + Cu | 1,50 |
Aplikasi Sel Volta

Sel volta memiliki berbagai aplikasi penting dalam kehidupan modern, baik sebagai sumber listrik maupun dalam elektrokimia.
Sumber Listrik
- Baterai: Sel volta digunakan dalam baterai, menyediakan daya untuk berbagai perangkat portabel, seperti ponsel, laptop, dan mobil listrik.
- Sel Bahan Bakar: Sel volta, khususnya sel bahan bakar hidrogen, digunakan untuk menghasilkan listrik dari reaksi kimia antara hidrogen dan oksigen, menawarkan alternatif energi bersih.
Elektrokimia
- Elektrolisis: Sel volta digunakan untuk memecah senyawa kimia menggunakan listrik, seperti dalam produksi hidrogen dari air atau ekstraksi logam dari bijihnya.
- Pelapisan Elektro: Sel volta digunakan untuk melapisi permukaan logam dengan logam lain, seperti pelapisan emas pada perhiasan atau pelapisan krom pada bagian mobil.
Contoh Penggunaan
- Baterai pada remote control televisi
- Sel bahan bakar yang digunakan pada kendaraan bertenaga hidrogen
- Proses pelapisan emas pada perhiasan
- Elektrolisis air untuk menghasilkan hidrogen dan oksigen
Sel Volta vs Sel Elektrolisis

Sel volta dan sel elektrolisis adalah dua jenis sel elektrokimia yang memanfaatkan reaksi redoks untuk menghasilkan atau mengonsumsi energi listrik. Meskipun keduanya melibatkan transfer elektron, mereka berbeda dalam beberapa aspek penting.
Komponen
- Sel Volta: Katoda (elektroda positif), anoda (elektroda negatif), larutan elektrolit yang mengandung ion-ion.
- Sel Elektrolisis: Elektroda positif (anoda), elektroda negatif (katoda), larutan elektrolit yang mengandung ion-ion.
Reaksi Kimia
- Sel Volta: Reaksi spontan (reaksi redoks) menghasilkan arus listrik.
- Sel Elektrolisis: Reaksi non-spontan (reaksi redoks) terjadi karena adanya arus listrik dari sumber eksternal.
Arah Aliran Arus
- Sel Volta: Elektron mengalir dari anoda ke katoda, menghasilkan arus listrik eksternal.
- Sel Elektrolisis: Elektron mengalir dari katoda ke anoda, mengonsumsi arus listrik eksternal.
Konversi Sel Volta ke Sel Elektrolisis
Sel volta dapat diubah menjadi sel elektrolisis dengan membalik polaritas elektroda. Hal ini mengubah arah aliran elektron, sehingga reaksi redoks non-spontan dapat terjadi.
Konversi Sel Elektrolisis ke Sel Volta
Sel elektrolisis dapat diubah menjadi sel volta dengan mengembalikan polaritas elektroda ke keadaan semula. Hal ini memungkinkan reaksi redoks spontan untuk menghasilkan arus listrik.
Terakhir

Gambar sel volta dan penjelasannya memberikan pemahaman mendalam tentang proses konversi energi kimia menjadi listrik. Melalui reaksi redoks, sel volta menghasilkan arus listrik yang dapat dimanfaatkan dalam berbagai aplikasi, termasuk baterai, sel bahan bakar, dan elektrokimia. Memahami prinsip-prinsip yang mendasarinya memungkinkan kita memanfaatkan kekuatan sel volta untuk memenuhi kebutuhan energi dan memajukan teknologi.
Sudut Pertanyaan Umum (FAQ)
Apa perbedaan utama antara sel volta dan sel elektrolisis?
Dalam sel volta, reaksi redoks spontan menghasilkan arus listrik, sedangkan pada sel elektrolisis, arus listrik digunakan untuk memaksa reaksi redoks yang tidak spontan.
Bagaimana cara meningkatkan potensial sel volta?
Potensial sel dapat ditingkatkan dengan menggunakan logam dengan potensial reduksi yang lebih tinggi sebagai anoda dan logam dengan potensial reduksi yang lebih rendah sebagai katoda, serta dengan meningkatkan konsentrasi reaktan dan menurunkan konsentrasi produk.