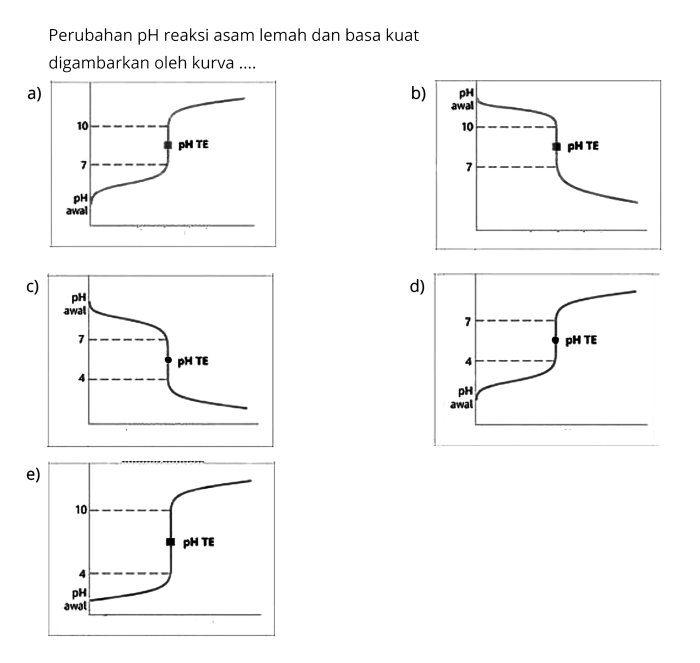
Dalam kimia analitik, grafik titrasi memainkan peran penting dalam menentukan konsentrasi asam dan basa. Titrasi asam lemah dengan basa kuat merupakan teknik umum yang digunakan untuk memahami sifat asam dan basa. Grafik yang dihasilkan dari titrasi ini memberikan wawasan berharga tentang interaksi kimia antara kedua jenis zat tersebut.
Dalam artikel ini, kita akan mengeksplorasi konsep grafik titrasi asam lemah basa kuat, menyelidiki faktor-faktor yang memengaruhinya, dan menguraikan aplikasi praktisnya. Kita juga akan membahas penentuan titik ekuivalen dan pH, serta menjawab pertanyaan umum yang sering diajukan tentang topik ini.
Pengertian Grafik Titrasi Asam Lemah Basa Kuat
Titrasi adalah teknik analitik yang digunakan untuk menentukan konsentrasi suatu larutan dengan menambahkan sejumlah larutan dengan konsentrasi yang diketahui secara bertahap.
Dalam titrasi asam lemah basa kuat, asam lemah bereaksi dengan basa kuat dalam reaksi netralisasi. Asam lemah terdisosiasi sebagian dalam air, sedangkan basa kuat terdisosiasi sempurna.
Kurva titrasi asam lemah basa kuat menunjukkan perubahan pH larutan saat basa kuat ditambahkan ke asam lemah. Kurva ini memiliki bentuk sigmoid, dengan titik ekivalen (titik di mana jumlah mol asam dan basa sama) pada pH sekitar 7.
Perbedaan Asam Lemah dan Basa Kuat
- Asam lemah terdisosiasi sebagian dalam air, menghasilkan konsentrasi ion H+ yang rendah.
- Basa kuat terdisosiasi sempurna dalam air, menghasilkan konsentrasi ion OH- yang tinggi.
- Asam lemah memiliki konstanta disosiasi asam (Ka) yang kecil, sedangkan basa kuat memiliki konstanta disosiasi basa (Kb) yang besar.
Faktor yang Mempengaruhi Grafik Titrasi
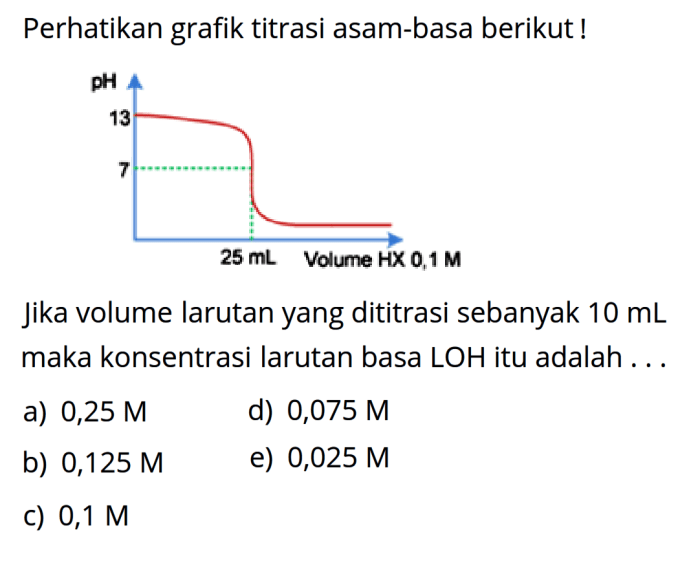
Bentuk kurva titrasi dipengaruhi oleh beberapa faktor, termasuk konsentrasi, suhu, dan kekuatan asam/basa.
Konsentrasi
Konsentrasi larutan yang dititrasi dan titran dapat memengaruhi bentuk kurva titrasi. Konsentrasi yang lebih tinggi menghasilkan perubahan pH yang lebih cepat, yang mengarah ke kurva yang lebih curam. Sebaliknya, konsentrasi yang lebih rendah menghasilkan perubahan pH yang lebih bertahap, menghasilkan kurva yang lebih landai.
Suhu
Suhu juga dapat memengaruhi bentuk kurva titrasi. Pada suhu yang lebih tinggi, konstanta disosiasi asam dan basa meningkat, yang mengarah ke kurva yang lebih curam. Sebaliknya, pada suhu yang lebih rendah, konstanta disosiasi menurun, yang mengarah ke kurva yang lebih landai.
Kekuatan Asam/Basa
Kekuatan asam dan basa yang dititrasi juga dapat memengaruhi bentuk kurva titrasi. Asam kuat dan basa kuat menghasilkan kurva titrasi yang sangat curam, sedangkan asam lemah dan basa lemah menghasilkan kurva yang lebih landai. Ini karena asam kuat dan basa kuat terdisosiasi sepenuhnya, sementara asam lemah dan basa lemah hanya terdisosiasi sebagian.
Contoh
- Titrasi asam kuat (seperti HCl) dengan basa kuat (seperti NaOH) menghasilkan kurva yang sangat curam dengan titik ekuivalen yang tajam.
- Titrasi asam lemah (seperti CH3COOH) dengan basa kuat menghasilkan kurva yang lebih landai dengan titik ekuivalen yang kurang tajam.
- Titrasi asam kuat dengan basa lemah menghasilkan kurva yang curam pada awalnya, tetapi kemudian menjadi lebih landai mendekati titik ekuivalen.
Penentuan Titik Ekivalen dan pH
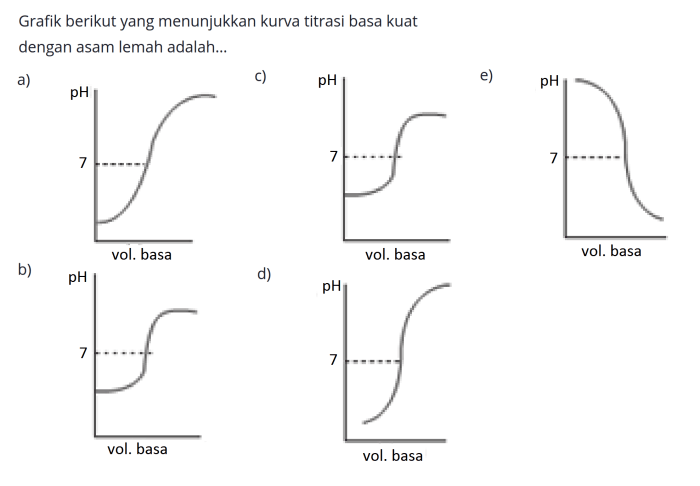
Titik ekivalen dalam titrasi asam lemah basa kuat adalah titik di mana jumlah mol asam sama dengan jumlah mol basa yang ditambahkan. Pada titik ini, semua asam telah dinetralkan, dan larutan berada pada keadaan netral.
Konsep pH penting dalam titrasi karena menunjukkan keasaman atau kebasaan larutan. pH didefinisikan sebagai logaritma negatif dari konsentrasi ion hidrogen dalam larutan.
Titik Ekivalen
Titik ekivalen dapat ditentukan dari kurva titrasi dengan mengidentifikasi titik di mana kurva berubah arah secara tiba-tiba. Perubahan arah ini menunjukkan bahwa asam telah dinetralkan sepenuhnya, dan tidak ada lagi ion hidrogen yang bereaksi dengan basa.
pH pada Titik-Titik Penting
Berikut adalah tabel yang menunjukkan pH larutan pada titik-titik penting titrasi:
| Titik | pH |
|---|---|
| Titik awal | < 7 |
| Titik setengah netralisasi | > 7 |
| Titik ekivalen | 7 |
| Titik akhir | > 7 |
Aplikasi Grafik Titrasi

Grafik titrasi adalah alat yang ampuh untuk menganalisis larutan asam-basa. Ini menyediakan informasi penting tentang sifat asam atau basa, konsentrasi, dan komposisi campuran.
Contoh Aplikasi
- Penentuan Konsentrasi Asam atau Basa: Grafik titrasi dapat digunakan untuk menentukan konsentrasi asam atau basa yang tidak diketahui dengan menetralkannya dengan larutan standar yang konsentrasinya diketahui.
- Analisis Campuran Asam atau Basa: Grafik titrasi dapat digunakan untuk mengidentifikasi dan mengukur konsentrasi asam atau basa yang berbeda dalam campuran. Ini dicapai dengan menganalisis titik ekuivalen yang sesuai pada grafik.
Keterbatasan Grafik Titrasi
Meskipun berguna, grafik titrasi memiliki beberapa keterbatasan:
- Gangguan: Beberapa ion atau molekul dapat mengganggu reaksi titrasi, menyebabkan hasil yang tidak akurat.
- Kesalahan Eksperimental: Kesalahan dalam pengukuran volume, konsentrasi, atau titik akhir dapat mempengaruhi akurasi hasil.
- Asam atau Basa Lemah: Grafik titrasi kurang akurat untuk asam atau basa lemah karena titik ekuivalen tidak selalu jelas.
Metode Alternatif
Selain grafik titrasi, ada beberapa metode alternatif untuk analisis asam-basa, seperti:
- Konduktometri: Mengukur perubahan konduktivitas larutan saat titrasi.
- Potensiometri: Mengukur potensial elektroda yang ditenggelamkan dalam larutan saat titrasi.
- Spektrofotometri: Mengukur perubahan serapan cahaya pada panjang gelombang tertentu saat titrasi.
Penutup

Grafik titrasi asam lemah basa kuat memberikan alat yang ampuh untuk menganalisis sifat asam dan basa. Dengan memahami faktor-faktor yang memengaruhi bentuk kurva titrasi dan teknik interpretasinya, para ilmuwan dapat memperoleh wawasan penting tentang konsentrasi, kekuatan, dan perilaku asam-basa. Selain itu, grafik titrasi memiliki aplikasi luas dalam bidang kimia, termasuk pengendalian kualitas, analisis lingkungan, dan pengembangan obat.
Pertanyaan dan Jawaban
Apa perbedaan utama antara asam lemah dan basa kuat?
Asam lemah hanya terdisosiasi sebagian dalam air, menghasilkan konsentrasi ion hidrogen yang lebih rendah. Sebaliknya, basa kuat terdisosiasi hampir sempurna dalam air, menghasilkan konsentrasi ion hidroksida yang tinggi.
Bagaimana cara menentukan titik ekuivalen dari grafik titrasi?
Titik ekuivalen adalah titik di mana jumlah mol asam sama dengan jumlah mol basa. Ini biasanya ditunjukkan oleh perubahan tajam pada pH atau konduktivitas larutan.
Apa keterbatasan grafik titrasi?
Grafik titrasi mungkin tidak akurat untuk asam atau basa yang sangat lemah atau kuat, atau jika ada reaksi samping yang terjadi.