Dunia kimia dipenuhi dengan prinsip-prinsip dasar yang mengatur perilaku zat dan reaksi di antara mereka. Hukum dasar kimia dan stoikiometri membentuk landasan bagi pemahaman kita tentang transformasi kimia, memungkinkan kita memprediksi dan mengendalikan reaksi yang membentuk dunia kita.
Hukum dasar kimia, seperti hukum kekekalan massa dan hukum perbandingan tetap, memberikan dasar yang kuat untuk stoikiometri, ilmu yang berfokus pada hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia.
Hukum Dasar Kimia
Hukum dasar kimia adalah prinsip fundamental yang mendasari perilaku materi dan reaksi kimia. Hukum-hukum ini memberikan dasar untuk memahami komposisi dan perubahan materi.
Hukum Kekekalan Massa
Hukum kekekalan massa menyatakan bahwa massa total reaktan dalam reaksi kimia sama dengan massa total produk. Hukum ini menyiratkan bahwa materi tidak dapat diciptakan atau dimusnahkan selama reaksi kimia, melainkan hanya berubah bentuk.
Hukum Perbandingan Tetap
Hukum perbandingan tetap menyatakan bahwa dalam suatu senyawa kimia, unsur-unsur penyusunnya selalu memiliki perbandingan massa yang tetap. Hukum ini menunjukkan bahwa komposisi senyawa kimia bersifat tetap dan tidak bergantung pada sumber atau metode pembuatannya.
Contoh Hukum Dasar Kimia dalam Kehidupan Sehari-hari
- Pembakaran bahan bakar: Ketika bahan bakar terbakar, massa total produk (karbon dioksida dan air) sama dengan massa total bahan bakar awal.
- Pembuatan garam: Ketika natrium dan klorin bereaksi untuk membentuk natrium klorida, perbandingan massa natrium dan klorin dalam senyawa tetap konstan.
- Pembuatan makanan: Resep kuliner sering kali mengandalkan hukum dasar kimia untuk memastikan keseimbangan dan kualitas makanan yang dihasilkan.
Stoikiometri
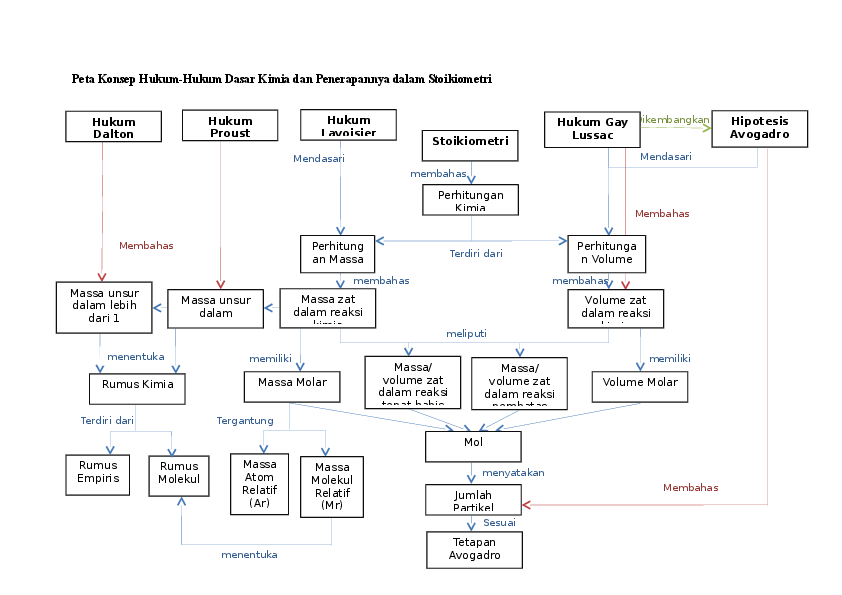
Stoikiometri adalah cabang kimia yang mempelajari hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia. Prinsip-prinsip stoikiometri didasarkan pada Hukum Kekekalan Massa, yang menyatakan bahwa massa total reaktan sama dengan massa total produk dalam reaksi kimia tertutup.
Rumus dan Persamaan dalam Stoikiometri
Stoikiometri menggunakan rumus dan persamaan untuk menentukan jumlah reaktan dan produk yang terlibat dalam suatu reaksi. Beberapa rumus dan persamaan yang umum digunakan antara lain:
- Persamaan reaksi kimia: Menunjukkan jenis dan jumlah reaktan dan produk yang terlibat dalam suatu reaksi.
- Rasio mol: Menunjukkan perbandingan mol reaktan dan produk yang bereaksi sesuai dengan persamaan reaksi.
- Massa molar: Menunjukkan massa satu mol suatu zat dalam gram.
- Persentase komposisi: Menunjukkan persentase massa setiap unsur dalam suatu senyawa.
Pentingnya Stoikiometri
Stoikiometri memiliki peran penting dalam bidang kimia, antara lain:
- Memprediksi hasil reaksi kimia: Stoikiometri memungkinkan kita menghitung jumlah reaktan dan produk yang diperlukan atau dihasilkan dalam suatu reaksi.
- Mendesain eksperimen kimia: Stoikiometri membantu menentukan jumlah reaktan dan kondisi reaksi yang diperlukan untuk mencapai hasil yang diinginkan.
- Aplikasi industri: Stoikiometri digunakan dalam berbagai aplikasi industri, seperti produksi bahan kimia, obat-obatan, dan bahan bakar.
li>Menganalisis data eksperimen: Stoikiometri dapat digunakan untuk menganalisis data eksperimen dan menentukan komposisi senyawa yang tidak diketahui.
Reaksi Kimia

Reaksi kimia merupakan suatu proses yang melibatkan perubahan komposisi kimia suatu zat atau lebih.
Reaksi kimia terjadi ketika ikatan kimia dalam suatu zat putus dan ikatan baru terbentuk, sehingga menghasilkan zat baru.
Jenis-Jenis Reaksi Kimia
Reaksi kimia dapat diklasifikasikan ke dalam beberapa jenis, antara lain:
- Reaksi Eksotermik: Reaksi yang melepaskan energi dalam bentuk panas atau cahaya.
- Reaksi Endotermik: Reaksi yang menyerap energi dari lingkungan dalam bentuk panas atau cahaya.
- Reaksi Redoks: Reaksi yang melibatkan perubahan bilangan oksidasi atom atau ion.
- Reaksi Asam-Basa: Reaksi yang melibatkan transfer proton antara asam dan basa.
- Reaksi Pengendapan: Reaksi yang menghasilkan zat padat tidak larut yang disebut endapan.
Metode Kesetimbangan Kimia
Kesetimbangan kimia adalah keadaan di mana laju reaksi maju dan laju reaksi balik sama. Untuk mencapai kesetimbangan kimia, reaksi kimia harus memenuhi beberapa langkah, yaitu:
- Reaksi maju dan reaksi balik terjadi secara simultan.
- Konsentrasi reaktan dan produk tidak berubah seiring waktu.
- Nilai tetapan kesetimbangan (Kc) tetap konstan.
Ilustrasi Proses Reaksi Kimia
Reaksi kimia dapat diilustrasikan dengan persamaan reaksi. Persamaan reaksi menunjukkan zat-zat yang bereaksi (reaktan) dan zat-zat yang dihasilkan (produk). Misalnya, persamaan reaksi untuk pembakaran metana adalah:
CH 4 + 2O 2 → CO 2 + 2H 2 O
Persamaan reaksi ini menunjukkan bahwa satu molekul metana bereaksi dengan dua molekul oksigen untuk menghasilkan satu molekul karbon dioksida dan dua molekul air.
Perhitungan Stoikiometri
Stoikiometri adalah studi tentang perbandingan kuantitatif reaktan dan produk dalam reaksi kimia. Perhitungan stoikiometri digunakan untuk menentukan massa reaktan atau produk yang terlibat dalam reaksi.
Langkah-langkah Perhitungan Stoikiometri
- Tulis persamaan reaksi kimia yang setara.
- Seimbangkan persamaan reaksi.
- Konversikan massa reaktan atau produk yang diketahui menjadi mol menggunakan massa molar.
- Gunakan koefisien stoikiometri untuk mengonversi mol reaktan atau produk yang diketahui menjadi mol reaktan atau produk yang tidak diketahui.
- Konversikan mol reaktan atau produk yang tidak diketahui menjadi massa menggunakan massa molar.
Contoh Perhitungan Stoikiometri
Menentukan Massa ReaktanMisalkan kita ingin menentukan massa metana (CH4) yang diperlukan untuk bereaksi dengan 10 gram oksigen (O2) dalam reaksi pembakaran berikut:“`CH4 + 2O2 → CO2 + 2H2O“`Langkah 1: Hitung mol oksigenMassa molar O2 = 32 g/molMol O2 = 10 g / 32 g/mol = 0,3125 molLangkah 2: Gunakan rasio mol untuk mengonversi mol O2 menjadi mol CH4Menurut persamaan reaksi, 2 mol O2 bereaksi dengan 1 mol CH4.Mol
CH4 = 0,3125 mol O2 x (1 mol CH4 / 2 mol O2) = 0,1563 molLangkah 3: Hitung massa CH4Massa molar CH4 = 16 g/molMassa CH4 = 0,1563 mol x 16 g/mol = 2,5 gJadi, diperlukan 2,5 gram metana untuk bereaksi dengan 10 gram oksigen.
Aplikasi Stoikiometri

Stoikiometri memiliki berbagai aplikasi dalam industri, penelitian lingkungan, dan kehidupan sehari-hari.
Industri
* Produksi bahan kimia: Stoikiometri digunakan untuk menentukan jumlah reaktan dan produk yang diperlukan dalam reaksi kimia untuk menghasilkan produk yang diinginkan.
Produksi obat-obatan
Stoikiometri penting untuk memastikan dosis dan kemurnian obat yang tepat.
Penelitian Lingkungan
* Pemantauan polusi udara: Stoikiometri membantu menentukan konsentrasi polutan di udara, seperti nitrogen oksida dan sulfur dioksida.
Pemantauan polusi air
Stoikiometri digunakan untuk menganalisis konsentrasi logam berat dan bahan kimia organik dalam air.
Kehidupan Sehari-hari
* Memasak: Stoikiometri membantu menentukan jumlah bahan yang diperlukan untuk membuat hidangan dengan rasa dan tekstur yang diinginkan.
Membersihkan
Stoikiometri membantu menentukan jumlah bahan kimia yang dibutuhkan untuk membuat larutan pembersih yang efektif.
Terakhir

Pemahaman yang komprehensif tentang hukum dasar kimia dan stoikiometri sangat penting bagi setiap ilmuwan, insinyur, dan individu yang ingin menguasai bahasa kimia. Dengan mengungkap prinsip-prinsip mendasar ini, kita dapat memecahkan masalah kimia yang kompleks, merancang reaksi baru, dan memahami peran penting kimia dalam kehidupan kita sehari-hari.
Tanya Jawab (Q&A)
Apa pentingnya hukum dasar kimia?
Hukum dasar kimia memberikan kerangka dasar untuk memahami sifat dan perilaku materi, memungkinkan kita untuk memprediksi hasil reaksi kimia dan menjelaskan pengamatan yang kita buat di dunia nyata.
Bagaimana stoikiometri digunakan dalam industri?
Stoikiometri sangat penting dalam industri kimia, memungkinkan produsen untuk mengoptimalkan proses, meminimalkan limbah, dan memastikan produksi yang efisien dari berbagai bahan kimia, obat-obatan, dan produk lainnya.
Apa aplikasi stoikiometri dalam kehidupan sehari-hari?
Stoikiometri memiliki aplikasi yang luas dalam kehidupan sehari-hari, seperti menentukan rasio bahan dalam memasak, memahami dosis obat, dan memprediksi produk pembersih yang aman dan efektif.