Ikatan kimia, ikatan yang menyatukan atom-atom, memainkan peran penting dalam menentukan bentuk molekul dan sifat fisik suatu zat. Dari jenis ikatan yang berbeda hingga pengaruhnya pada geometri molekul, pemahaman tentang ikatan kimia sangat penting dalam memahami dunia kimia.
Topik ini akan mengeksplorasi jenis-jenis ikatan kimia, membahas geometri molekul berdasarkan teori VSEPR, dan menyelidiki polaritas ikatan. Selain itu, akan dibahas juga gaya antarmolekul, dampak ikatan kimia pada sifat fisik, dan peran ikatan kimia dalam reaksi kimia.
Jenis-jenis Ikatan Kimia
Ikatan kimia adalah gaya yang menyatukan dua atau lebih atom untuk membentuk molekul atau senyawa. Ada tiga jenis utama ikatan kimia: ionik, kovalen, dan logam.
Ikatan Ionik
Ikatan ionik terjadi ketika satu atom melepaskan elektron ke atom lain, menciptakan ion positif dan negatif. Ion-ion ini kemudian saling tarik-menarik oleh gaya elektrostatik, membentuk ikatan ionik. Contoh ikatan ionik adalah natrium klorida (NaCl), di mana atom natrium melepaskan satu elektron ke atom klorin.
Ikatan Kovalen
Ikatan kovalen terjadi ketika dua atom berbagi elektron. Atom-atom ini saling tumpang tindih orbitalnya, menciptakan awan elektron yang mengelilingi kedua atom. Contoh ikatan kovalen adalah metana (CH 4 ), di mana atom karbon berbagi empat elektron dengan empat atom hidrogen.
Ikatan Logam
Ikatan logam terjadi antara atom-atom logam. Atom-atom ini melepaskan elektron valensinya ke dalam lautan elektron yang mengelilingi semua atom logam. Ikatan logam kuat dan dapat dideformasi, sehingga logam memiliki sifat seperti keuletan dan konduktivitas listrik yang tinggi.
Geometri Molekul
Geometri molekul adalah susunan spasial atom-atom dalam sebuah molekul. Bentuk molekul menentukan sifat-sifat fisik dan kimianya.
Teori VSEPR (Valence Shell Electron Pair Repulsion) digunakan untuk memprediksi geometri molekul. Teori ini menyatakan bahwa pasangan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat saling tolak menolak, sehingga molekul akan mengadopsi bentuk yang meminimalkan tolakan ini.
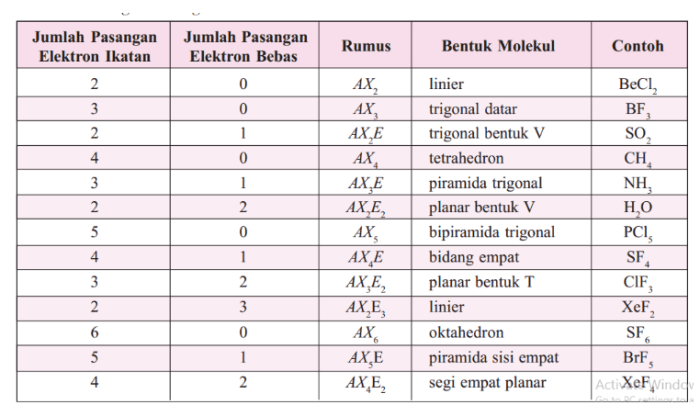
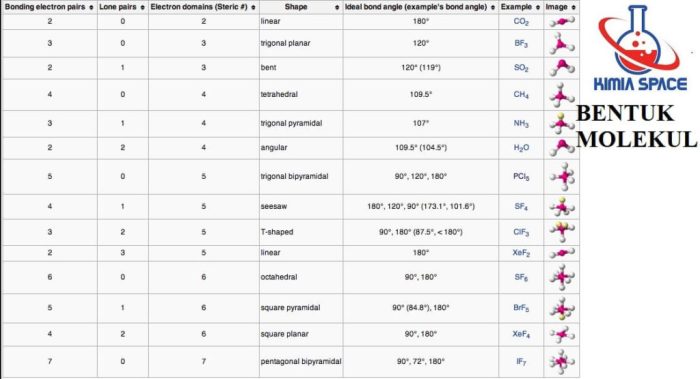
Tabel Bentuk Molekul Berdasarkan Jumlah Pasangan Elektron Ikatan dan Pasangan Elektron Bebas
| Pasangan Elektron Ikatan | Pasangan Elektron Bebas | Bentuk Molekul |
|---|---|---|
| 2 | 0 | Linear |
| 2 | 1 | Bengkok |
| 3 | 0 | Trigonal Planar |
| 3 | 1 | Piramida Trigonal |
| 4 | 0 | Tetrahedral |
| 4 | 1 | Bentuk T |
| 5 | 0 | Trigonal Bipiramidal |
| 5 | 1 | Bentuk Segi Empat Datar |
| 6 | 0 | Oktahedral |
Polaritas Ikatan
Polaritas ikatan mengacu pada pembagian elektron yang tidak merata dalam ikatan kimia. Hal ini terjadi ketika atom-atom yang terlibat memiliki keelektronegatifan yang berbeda, yaitu ukuran kemampuan atom untuk menarik elektron.
Untuk menentukan polaritas ikatan, kita membandingkan keelektronegatifan atom-atom yang terlibat. Jika selisih keelektronegatifannya besar, ikatan tersebut cenderung polar. Sebaliknya, jika selisihnya kecil, ikatan tersebut cenderung nonpolar.
Contoh Ikatan Polar dan Nonpolar
- Ikatan polar: H-Cl (selisih keelektronegatifan = 0,9), NaCl (selisih keelektronegatifan = 1,0)
- Ikatan nonpolar: H-H (selisih keelektronegatifan = 0), Cl-Cl (selisih keelektronegatifan = 0)
Distribusi Muatan pada Ikatan Polar
Dalam ikatan polar, elektron tertarik ke atom yang lebih elektronegatif, sehingga menciptakan distribusi muatan yang tidak merata. Atom yang lebih elektronegatif memperoleh muatan parsial negatif (δ-), sedangkan atom yang kurang elektronegatif memperoleh muatan parsial positif (δ+).
Distribusi muatan ini dapat digambarkan sebagai:
| Atom | Muatan |
|---|---|
| Lebih Elektronegatif | δ- |
| Kurang Elektronegatif | δ+ |
Gaya Antarmolekul
Gaya antarmolekul adalah gaya tarik-menarik yang bekerja antara molekul-molekul yang berdekatan. Gaya-gaya ini bertanggung jawab atas sifat fisika suatu zat, seperti titik leleh, titik didih, dan kelarutan.
Ada dua jenis utama gaya antarmolekul: gaya van der Waals dan ikatan hidrogen.
Gaya van der Waals
Gaya van der Waals adalah gaya tarik-menarik yang lemah yang terjadi antara semua molekul. Gaya-gaya ini disebabkan oleh fluktuasi distribusi elektron dalam molekul, yang menciptakan dipol sesaat. Dipol sesaat ini dapat menginduksi dipol sesaat pada molekul tetangga, yang mengarah pada gaya tarik-menarik antara molekul-molekul tersebut.
Kekuatan gaya van der Waals bergantung pada ukuran dan bentuk molekul. Molekul yang lebih besar dan lebih kompleks memiliki gaya van der Waals yang lebih kuat daripada molekul yang lebih kecil dan lebih sederhana.
Ikatan Hidrogen
Ikatan hidrogen adalah jenis gaya antarmolekul yang lebih kuat yang terjadi antara molekul yang mengandung atom hidrogen yang terikat pada atom elektronegatif, seperti oksigen, nitrogen, atau fluor. Ikatan hidrogen terjadi ketika atom hidrogen dalam suatu molekul berinteraksi dengan pasangan elektron bebas pada atom elektronegatif dalam molekul lain.
Ikatan hidrogen lebih kuat daripada gaya van der Waals dan dapat memiliki pengaruh yang signifikan pada sifat fisika suatu zat. Misalnya, air memiliki titik didih yang relatif tinggi karena adanya ikatan hidrogen yang kuat antara molekul-molekul air.
Dampak Ikatan Kimia pada Sifat Fisika
Jenis ikatan kimia dalam suatu zat sangat mempengaruhi sifat fisikanya, seperti titik leleh, titik didih, dan kelarutan.
Titik Leleh dan Titik Didih
- Zat dengan ikatan kovalen yang kuat, seperti berlian, memiliki titik leleh dan titik didih yang sangat tinggi karena energi yang dibutuhkan untuk memutuskan ikatan ini sangat besar.
- Zat dengan ikatan ionik, seperti garam meja, juga memiliki titik leleh dan titik didih yang tinggi karena gaya tarik-menarik elektrostatik yang kuat antara ion-ion berlawanan muatan.
- Zat dengan ikatan van der Waals, seperti gas mulia, memiliki titik leleh dan titik didih yang sangat rendah karena gaya tarik-menarik antar molekul sangat lemah.
Kelarutan
- Zat polar, yang memiliki ikatan kovalen polar atau ikatan ionik, cenderung larut dalam pelarut polar, seperti air, karena dapat membentuk ikatan hidrogen atau interaksi ion-dipol.
- Zat nonpolar, yang memiliki ikatan kovalen nonpolar, cenderung larut dalam pelarut nonpolar, seperti minyak, karena dapat membentuk gaya van der Waals.
Ikatan Kimia dalam Reaksi Kimia

Ikatan kimia berperan penting dalam reaksi kimia, di mana ikatan kimia lama dipatahkan dan ikatan kimia baru terbentuk untuk menghasilkan zat baru. Pemutusan dan pembentukan ikatan ini menentukan sifat dan hasil reaksi kimia.
Peran Ikatan Kimia dalam Reaksi Kimia
- Menentukan jenis dan jumlah reaktan yang diperlukan.
- Menentukan laju reaksi dan mekanisme reaksi.
- Memprediksi hasil reaksi dan struktur produk.
Pemutusan dan Pembentukan Ikatan
Dalam reaksi kimia, ikatan kimia dipatahkan ketika energi diberikan pada sistem, baik dalam bentuk panas, cahaya, atau energi listrik. Energi ini mengatasi energi ikat ikatan yang ada, menyebabkan ikatan tersebut putus dan atom-atom atau ion-ion yang terlibat menjadi bebas.
Pembentukan ikatan baru terjadi ketika atom atau ion bebas berinteraksi dan berbagi atau mentransfer elektron untuk mencapai konfigurasi elektron yang lebih stabil. Energi yang dilepaskan selama pembentukan ikatan ini mengimbangi energi yang digunakan untuk memutus ikatan awal, menghasilkan produk yang lebih stabil.
Contoh Reaksi Kimia
- Pembakaran Metana: CH4 + 2O2 → CO2 + 2H2O
- Reaksi Sintetis Air: 2H2 + O2 → 2H2O
- Reaksi Penguraian Air: 2H2O → 2H2 + O2
Ringkasan Akhir

Ikatan kimia, dengan keragaman dan kompleksitasnya, merupakan dasar dari struktur dan sifat materi. Memahami konsep-konsep yang terkait dengan ikatan kimia memungkinkan kita untuk memprediksi dan memanipulasi sifat zat, membuka jalan bagi kemajuan dalam berbagai bidang, termasuk material canggih, obat-obatan, dan katalisis.
Jawaban yang Berguna
Apa perbedaan antara ikatan ionik dan kovalen?
Ikatan ionik melibatkan transfer elektron dari satu atom ke atom lain, membentuk ion. Ikatan kovalen terbentuk ketika atom-atom berbagi pasangan elektron.
Bagaimana teori VSEPR digunakan untuk memprediksi bentuk molekul?
Teori VSEPR (Valence Shell Electron Pair Repulsion) memprediksi bentuk molekul berdasarkan tolakan pasangan elektron ikatan dan pasangan elektron bebas.
Mengapa beberapa ikatan bersifat polar?
Polaritas ikatan muncul ketika elektron-elektron dalam ikatan tidak terdistribusi secara merata, menghasilkan pemisahan muatan parsial positif dan negatif.
Bagaimana gaya van der Waals mempengaruhi sifat fisik suatu zat?
Gaya van der Waals adalah gaya tarik-menarik antarmolekul yang lemah, yang mempengaruhi sifat-sifat seperti titik leleh dan titik didih.
Bagaimana ikatan kimia berperan dalam reaksi kimia?
Dalam reaksi kimia, ikatan kimia dipatahkan dan terbentuk kembali, mengatur susunan ulang atom dan pembentukan molekul baru.