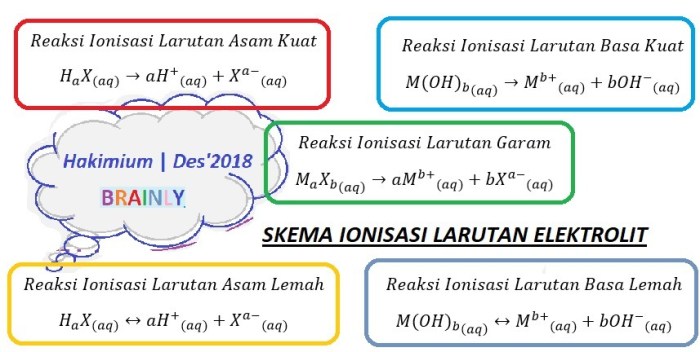
Dalam dunia larutan kimia, kesetimbangan ion memainkan peran penting dalam membentuk komposisi dan sifatnya. Kesetimbangan ion terjadi ketika laju pembentukan dan penguraian ion dalam larutan menjadi sama, sehingga konsentrasi ion tetap konstan.
Proses ini sangat penting dalam berbagai bidang, mulai dari biologi hingga industri. Dengan memahami kesetimbangan ion, kita dapat mengendalikan dan memanipulasi komposisi larutan untuk berbagai tujuan praktis.
Konsep Kesetimbangan Ion

Kesetimbangan ion adalah suatu keadaan di mana konsentrasi ion dalam suatu larutan tidak berubah seiring waktu. Hal ini terjadi ketika laju pembentukan ion sama dengan laju penguraian ion.
Salah satu contoh sederhana kesetimbangan ion adalah disosiasi asam lemah dalam air. Misalnya, ketika asam asetat (CH 3 COOH) dilarutkan dalam air, ia terdisosiasi menjadi ion asetat (CH 3 COO – ) dan ion hidrogen (H + ).
Reaksi Disosiasi Asam Lemah
- CH3COOH(aq) + H2O(l) ⇌ CH3COO–(aq) + H+(aq)
Pada kesetimbangan, laju disosiasi asam asetat sama dengan laju rekombinasi ion asetat dan ion hidrogen. Dengan demikian, konsentrasi ion asetat dan ion hidrogen dalam larutan tetap konstan.
Faktor yang Mempengaruhi Kesetimbangan Ion
Kesetimbangan ion dalam larutan dapat digeser oleh beberapa faktor, termasuk:
Konsentrasi
Menambah konsentrasi ion reaksi akan menggeser kesetimbangan ke arah produk. Sebaliknya, menurunkan konsentrasi ion reaksi akan menggeser kesetimbangan ke arah reaktan.Misalnya, dalam kesetimbangan berikut:“`Ag + + Cl – ⇌ AgCl(s)“`Jika konsentrasi ion Ag + atau Cl – ditingkatkan, kesetimbangan akan bergeser ke arah pembentukan endapan AgCl(s).
Suhu
Untuk reaksi eksotermik (melepaskan panas), meningkatkan suhu akan menggeser kesetimbangan ke arah reaktan. Sebaliknya, untuk reaksi endotermik (menyerap panas), meningkatkan suhu akan menggeser kesetimbangan ke arah produk.
Penambahan Ion Bersama
Menambahkan ion yang memiliki muatan yang sama dengan salah satu ion reaksi akan menggeser kesetimbangan ke arah ion yang ditambahkan. Ini dikenal sebagai efek ion bersama.Misalnya, dalam kesetimbangan berikut:“`Ag + + 2NH 3 ⇌ [Ag(NH 3 ) 2 ] + “`Jika ion NH 4 + ditambahkan, kesetimbangan akan bergeser ke arah reaktan, mengurangi konsentrasi ion [Ag(NH 3 ) 2 ] + .
Aplikasi Kesetimbangan Ion

Kesetimbangan ion memainkan peran penting dalam berbagai aspek kehidupan sehari-hari dan proses industri.
Dalam Sistem Biologis
- Pengaturan pH darah: Ion hidrogen (H+) berperan penting dalam mengatur pH darah, yang sangat penting untuk fungsi enzim dan proses biologis lainnya.
- Transmisi impuls saraf: Ion natrium (Na+) dan kalium (K+) terlibat dalam transmisi impuls saraf, memungkinkan komunikasi antara sel-sel saraf.
- Kontraksi otot: Ion kalsium (Ca2+) berperan dalam kontraksi otot, memungkinkan gerakan dan aktivitas fisik.
Dalam Proses Industri
- Produksi kertas: Kesetimbangan ion digunakan untuk mengontrol pH larutan dalam proses pembuatan kertas, yang mempengaruhi kualitas dan kekuatan kertas yang dihasilkan.
- Pemurnian air: Kesetimbangan ion digunakan untuk menghilangkan ion yang tidak diinginkan dari air, seperti ion logam berat, untuk memastikan keamanan dan kualitas air minum.
- Elektroplating: Kesetimbangan ion digunakan untuk mengontrol konsentrasi ion logam dalam larutan elektroplating, yang mempengaruhi kualitas dan ketebalan lapisan logam yang dihasilkan.
Diagram Alur untuk Memecahkan Masalah Kesetimbangan Ion
Untuk memecahkan masalah kesetimbangan ion, langkah-langkah berikut dapat diikuti:
- Identifikasi reaksi kesetimbangan yang relevan.
- Tuliskan persamaan kesetimbangan untuk reaksi tersebut.
- Tentukan nilai konstanta kesetimbangan (K).
- Substitusikan nilai yang diketahui ke dalam persamaan kesetimbangan dan selesaikan untuk konsentrasi yang tidak diketahui.
- Verifikasi apakah solusi yang diperoleh masuk akal dan sesuai dengan kondisi awal.
Studi Kasus

Studi kasus berikut menggambarkan penerapan kesetimbangan ion dalam pemecahan masalah nyata.
Studi kasus ini melibatkan penentuan konsentrasi ion logam dalam larutan dengan menggunakan titrasi pengendapan.
Prosedur
- Siapkan larutan yang mengandung ion logam yang tidak diketahui konsentrasinya.
- Tambahkan indikator yang akan membentuk endapan berwarna dengan ion logam.
- Tambahkan larutan standar yang mengandung ion yang akan bereaksi dengan ion logam, membentuk endapan.
- Tambahkan larutan standar secara bertahap hingga terjadi perubahan warna pada indikator, yang menandakan titik akhir titrasi.
- Catat volume larutan standar yang ditambahkan untuk mencapai titik akhir.
Hasil
Dari volume larutan standar yang ditambahkan, konsentrasi ion logam dalam larutan awal dapat dihitung menggunakan persamaan stoikiometri.
Studi kasus ini menunjukkan bagaimana kesetimbangan ion dapat digunakan untuk menentukan konsentrasi ion dalam larutan secara akurat dan tepat.
Simpulan Akhir

Kesetimbangan ion adalah konsep mendasar yang memberikan pemahaman tentang perilaku larutan kimia. Dengan mempertimbangkan faktor-faktor yang mempengaruhi kesetimbangan ion dan metode penentuannya, kita dapat memanfaatkan prinsip ini untuk memecahkan masalah dunia nyata dan memajukan pengetahuan ilmiah.
Pertanyaan Umum yang Sering Muncul
Apa itu koefisien kesetimbangan?
Koefisien kesetimbangan adalah nilai konstan yang menyatakan perbandingan konsentrasi ion pada kesetimbangan.
Bagaimana cara menggeser kesetimbangan ion?
Kesetimbangan ion dapat digeser dengan mengubah konsentrasi ion, suhu, atau menambahkan ion bersama.
Apa saja aplikasi kesetimbangan ion dalam kehidupan sehari-hari?
Kesetimbangan ion berperan dalam sistem biologis, seperti pengaturan pH darah, dan dalam proses industri, seperti produksi pupuk dan obat-obatan.