Praktikum sel volta menawarkan wawasan mendalam tentang reaksi redoks, menyediakan dasar untuk pemahaman komprehensif tentang prinsip-prinsip elektrokimia. Eksperimen ini memungkinkan penyelidikan langsung komponen, pengukuran, dan aplikasi praktis sel volta, memberikan bukti empiris untuk teori yang mendasarinya.
Dengan mengamati reaksi redoks yang terjadi pada elektroda dan menganalisis data yang diperoleh, siswa memperoleh pemahaman tentang peran konsentrasi larutan dan suhu dalam mempengaruhi potensial sel. Eksperimen ini juga menyoroti sumber kesalahan eksperimental dan langkah-langkah untuk meminimalkannya, menanamkan pentingnya akurasi dan ketelitian dalam penelitian ilmiah.
Reaksi Redoks dan Sel Volta
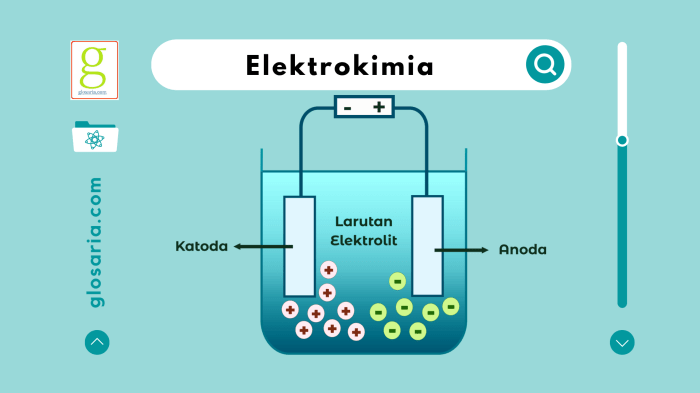
Reaksi redoks (reduksi-oksidasi) adalah reaksi kimia yang melibatkan transfer elektron antar spesies kimia. Dalam reaksi redoks, satu spesies mengalami reduksi (penerimaan elektron) dan spesies lainnya mengalami oksidasi (pelepasan elektron).
Sel volta adalah perangkat elektrokimia yang mengubah energi kimia dari reaksi redoks menjadi energi listrik. Sel volta terdiri dari dua elektroda (anoda dan katoda) yang terhubung melalui larutan elektrolit.
Contoh Reaksi Redoks dalam Sel Volta
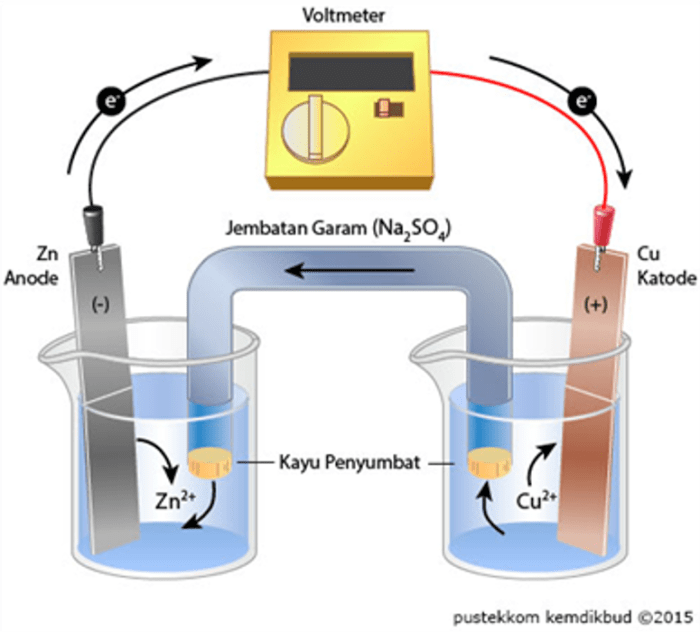
Salah satu reaksi redoks yang umum digunakan dalam sel volta adalah reaksi antara seng dan tembaga:
- Oksidasi (anoda): Zn → Zn2+ + 2e–
- Reduksi (katoda): Cu2+ + 2e– → Cu
Dalam reaksi ini, seng mengalami oksidasi, kehilangan dua elektron, dan berubah menjadi ion seng(II). Elektron yang dilepaskan oleh seng diterima oleh ion tembaga(II), yang mengalami reduksi dan berubah menjadi logam tembaga.
Komponen Sel Volta
Sel volta adalah perangkat elektrokimia yang mengubah energi kimia menjadi energi listrik. Sel volta terdiri dari dua elektroda yang terendam dalam larutan elektrolit dan dihubungkan oleh jembatan garam.
Komponen utama sel volta meliputi:
Elektroda
- Anoda: Elektroda negatif tempat reaksi oksidasi terjadi.
- Katoda: Elektroda positif tempat reaksi reduksi terjadi.
Larutan Elektrolit
- Larutan yang mengandung ion yang dapat bergerak bebas dan menghantarkan arus listrik.
- Biasanya berupa larutan asam, basa, atau garam.
Jembatan Garam
- Tabung berisi larutan elektrolit yang menghubungkan kedua larutan elektrolit.
- Memungkinkan pergerakan ion untuk menjaga netralitas listrik.
Tabel Komponen Sel Volta
| Komponen | Bahan |
|---|---|
| Anoda | Zn (seng) |
| Katoda | Cu (tembaga) |
| Larutan Elektrolit | ZnSO4 (larutan seng sulfat) |
| Jembatan Garam | KCl (larutan kalium klorida) |
Pengukuran Potensial Sel
Pengukuran potensial sel adalah penentuan beda potensial antara dua elektroda dalam larutan elektrolit. Potensial sel dapat diukur menggunakan voltmeter yang terhubung ke elektroda.
Prinsip Pengukuran Potensial Sel
Prinsip pengukuran potensial sel didasarkan pada reaksi redoks yang terjadi pada elektroda. Reaksi redoks melibatkan transfer elektron antara dua spesies kimia. Ketika dua elektroda dengan potensial redoks yang berbeda dicelupkan ke dalam larutan elektrolit, elektron akan mengalir dari elektroda dengan potensial lebih tinggi ke elektroda dengan potensial lebih rendah.
Aliran elektron ini menghasilkan beda potensial yang dapat diukur dengan voltmeter.
Faktor-Faktor yang Mempengaruhi Potensial Sel
Beberapa faktor yang mempengaruhi potensial sel antara lain:
- Konsentrasi larutan elektrolit: Semakin tinggi konsentrasi larutan, semakin besar potensial sel.
- Suhu: Semakin tinggi suhu, semakin kecil potensial sel.
Penerapan Sel Volta
Sel volta memiliki berbagai penerapan praktis dalam kehidupan sehari-hari, terutama sebagai sumber energi pada perangkat elektronik.
Baterai
- Baterai merupakan perangkat yang menyimpan energi kimia dalam bentuk sel volta.
- Saat digunakan, reaksi kimia terjadi pada baterai, menghasilkan aliran elektron yang menghasilkan arus listrik.
- Baterai digunakan dalam berbagai perangkat, seperti ponsel, laptop, dan jam tangan.
Aki
- Aki merupakan jenis baterai isi ulang yang digunakan pada kendaraan.
- Aki menyediakan daya untuk menghidupkan mesin dan memberi energi pada sistem kelistrikan kendaraan.
- Aki bekerja dengan prinsip yang sama dengan baterai, tetapi dapat diisi ulang dengan menghubungkan ke sumber listrik eksternal.
Percobaan Praktikum
Praktikum sel volta bertujuan untuk mengukur potensial sel dan menentukan jenis reaksi yang terjadi.
Langkah-langkah Percobaan
- Persiapkan bahan: sel volta, voltmeter, larutan elektrolit, elektroda.
- Rakit sel volta dengan menghubungkan elektroda ke voltmeter.
- Tuangkan larutan elektrolit ke dalam sel volta.
- Ukur potensial sel menggunakan voltmeter.
- Tentukan jenis reaksi yang terjadi berdasarkan nilai potensial sel.
Bagan Alur Percobaan
Berikut adalah bagan alur yang mengilustrasikan langkah-langkah percobaan:
- Persiapkan bahan
- Rakit sel volta
- Tuangkan larutan elektrolit
- Ukur potensial sel
- Tentukan jenis reaksi
Analisis Data

Analisis data dalam praktikum sel volta bertujuan untuk menentukan potensial sel dan hubungannya dengan konsentrasi larutan yang digunakan.
Potensial sel dapat dihitung menggunakan persamaan Nernst:
E sel = E 0 sel
(RT/nF)ln(Q)
di mana:
- Esel adalah potensial sel
- E0sel adalah potensial sel standar
- R adalah konstanta gas ideal (8,314 J/mol·K)
- T adalah suhu dalam Kelvin
- n adalah jumlah elektron yang ditransfer dalam reaksi
- F adalah konstanta Faraday (96.485 C/mol)
- Q adalah hasil bagi konsentrasi produk dan reaktan
Hubungan Potensial Sel dengan Konsentrasi Larutan
Persamaan Nernst menunjukkan bahwa potensial sel berbanding lurus dengan logaritma konsentrasi larutan. Semakin tinggi konsentrasi larutan, semakin tinggi potensial sel.
Hubungan ini dapat diilustrasikan dengan grafik potensial sel versus logaritma konsentrasi larutan. Grafik akan menunjukkan garis lurus dengan kemiringan yang sebanding dengan (RT/nF).
Kesalahan Eksperimen
Dalam percobaan sel volta, terdapat beberapa sumber kesalahan yang dapat mempengaruhi akurasi hasil.
Salah satu sumber kesalahan adalah hambatan kontak antara elektroda dan larutan elektrolit. Hambatan ini dapat menyebabkan penurunan potensial sel dan mempengaruhi pengukuran arus listrik.
Cara Meminimalkan Kesalahan
- Gunakan elektroda dengan permukaan bersih dan bebas dari kontaminasi.
- Pastikan kontak yang baik antara elektroda dan larutan elektrolit.
- Gunakan larutan elektrolit dengan konsentrasi yang tepat.
- Kalibrasi peralatan secara teratur untuk memastikan akurasi pengukuran.
Akhir Kata
Kesimpulan dari praktikum sel volta memperkuat prinsip-prinsip elektrokimia, menunjukkan hubungan antara reaksi kimia dan aliran elektron. Pengalaman langsung ini membekali siswa dengan dasar yang kuat untuk eksplorasi lebih lanjut di bidang elektrokimia, termasuk pengembangan perangkat energi dan teknologi sensor.
Pertanyaan dan Jawaban
Apa manfaat utama dari praktikum sel volta?
Praktikum sel volta memberikan pengalaman langsung dalam mengamati dan menganalisis reaksi redoks, meningkatkan pemahaman tentang prinsip elektrokimia dan penerapannya dalam kehidupan sehari-hari.
Bagaimana konsentrasi larutan mempengaruhi potensial sel?
Konsentrasi larutan mempengaruhi potensial sel karena konsentrasi ion yang lebih tinggi menyebabkan lebih banyak reaksi redoks dan peningkatan potensial sel.
Apa sumber kesalahan umum dalam percobaan sel volta?
Sumber kesalahan umum termasuk kesalahan dalam pengukuran volume, kesalahan dalam pengukuran konsentrasi, dan kesalahan dalam penggunaan peralatan.
