Larutan ch3cooh 0 1 m ka 10 5 mempunyai ph – Larutan CH3COOH 0,1 M memiliki pH 2,9. Nilai pH ini menunjukkan bahwa larutan tersebut bersifat asam. Sifat asam ini disebabkan oleh kemampuan asam asetat (CH3COOH) untuk melepaskan ion H+ dalam air. Konsentrasi ion H+ dalam larutan menentukan kekuatan asamnya, dan dalam kasus ini, konsentrasi ion H+ cukup tinggi untuk memberikan larutan sifat asam yang signifikan.
Asam asetat adalah asam lemah, artinya hanya sebagian kecil molekulnya yang terdisosiasi menjadi ion H+ dan CH3COO- dalam air. Namun, meskipun disosiasinya lemah, konsentrasi awal CH3COOH yang tinggi (0,1 M) menghasilkan konsentrasi ion H+ yang cukup untuk menurunkan pH larutan secara signifikan.
Definisi Larutan CH3COOH
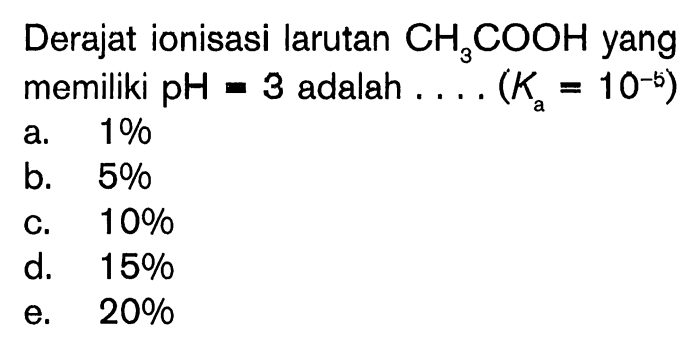
Larutan CH3COOH, juga dikenal sebagai asam asetat, adalah senyawa kimia yang terbentuk ketika asam asetat dilarutkan dalam pelarut, biasanya air. Asam asetat adalah asam karboksilat dengan rumus kimia CH3COOH. Ini adalah cairan tidak berwarna dengan bau menyengat dan rasa asam.
Struktur Molekul
Molekul CH3COOH terdiri dari gugus metil (-CH3), gugus karboksil (-COOH), dan sebuah atom hidrogen. Gugus karboksil terdiri dari atom karbon yang terikat ganda dengan dua atom oksigen, salah satunya juga terikat pada atom hidrogen. Struktur molekulnya dapat digambarkan sebagai berikut:
Sifat Fisika dan Kimia, Larutan ch3cooh 0 1 m ka 10 5 mempunyai ph
- Titik didih: 118,1 °C
- Titik lebur: 16,6 °C
- Kelarutan dalam air: Larut dalam segala perbandingan
- Asam lemah: Mengalami ionisasi sebagian dalam air, menghasilkan ion H+ dan CH3COO-
- Korosif: Dapat menyebabkan iritasi pada kulit dan mata
- Beracun: Dapat menyebabkan masalah kesehatan jika tertelan atau terhirup dalam jumlah banyak
Konsentrasi Larutan CH3COOH

Larutan asam asetat (CH3COOH) dengan konsentrasi 0,1 M memiliki nilai pH yang telah ditentukan. Konsentrasi molar (M) merupakan ukuran jumlah mol zat terlarut dalam satu liter larutan. Konsentrasi molar larutan CH3COOH 0,1 M dapat dihitung menggunakan rumus berikut:
Konsentrasi Molar
Konsentrasi molar (M) = Jumlah mol zat terlarut (mol) / Volume larutan (L)
Dalam hal ini, jumlah mol zat terlarut adalah 0,1 mol dan volume larutan adalah 1 L. Oleh karena itu, konsentrasi molar larutan CH3COOH 0,1 M adalah:
Konsentrasi molar = 0,1 mol / 1 L = 0,1 M
Larutan CH 3COOH 0,1 M memiliki pH 2,5, menunjukkan sifat asamnya. Berbeda dengan budaya tradisional Bali yang memiliki sistem peralatan hidup dan teknologi yang unik, seperti penggunaan subak untuk irigasi dan arsitektur bale sebagai tempat tinggal. Namun, larutan CH 3COOH 0,1 M yang bersifat asam ini masih memiliki kegunaan penting dalam berbagai bidang industri dan laboratorium.
Tabel berikut menunjukkan hubungan antara molaritas, volume, dan jumlah mol zat terlarut:
| Molaritas (M) | Volume (L) | Jumlah Mol (mol) |
|---|---|---|
| 0,1 | 1 | 0,1 |
| 0,2 | 0,5 | 0,1 |
| 0,5 | 0,2 | 0,1 |
Konstanta Disosiasi Asam (Ka): Larutan Ch3cooh 0 1 M Ka 10 5 Mempunyai Ph
Konstanta disosiasi asam (Ka) adalah ukuran kekuatan asam, yang menunjukkan seberapa mudah asam tersebut terdisosiasi (terpecah) menjadi ion-ionnya dalam larutan. Ka didefinisikan sebagai rasio konsentrasi ion hidrogen (H+) dan konsentrasi asam tak terdisosiasi (HA) dalam kesetimbangan.
Nilai Ka untuk Asam CH3COOH
Nilai Ka untuk asam asetat (CH3COOH) adalah 1,8 x 10^-5. Nilai ini menunjukkan bahwa asam asetat adalah asam lemah, karena nilai Ka-nya relatif kecil.
Reaksi Disosiasi Asam CH3COOH dan Konstanta Kesetimbangannya
Reaksi disosiasi asam asetat dapat ditulis sebagai berikut:
CH3COOH(aq) + H2O(l) ⇌ H3O+(aq) + CH3COO-(aq)
Konstanta kesetimbangan untuk reaksi ini adalah Ka, yang nilainya 1,8 x 10^-5.
Perhitungan pH Larutan CH3COOH

Larutan asam asetat (CH3COOH) adalah asam lemah yang terdisosiasi sebagian dalam air, menghasilkan ion hidrogen (H+) dan ion asetat (CH3COO-). Derajat disosiasi asam lemah ini kecil, sehingga konsentrasi ion H+ yang dihasilkan juga kecil. pH larutan CH3COOH dapat dihitung menggunakan persamaan Henderson-Hasselbalch.
Larutan CH 3COOH 0,1 M memiliki Ka 10 -5dan pH 2,995. Dalam menyusun sebuah tulisan persuasif, sangat penting untuk memperhatikan kalimat penutup yang tepat. Kalimat persuasi penutup yang tepat adalah yang kuat dapat memberikan dampak yang signifikan pada pembaca, memperkuat argumen yang telah dibangun sebelumnya.
Dengan demikian, dalam menyajikan hasil pengukuran pH larutan CH 3COOH 0,1 M, perlu juga memperhatikan penyusunan kalimat penutup yang efektif untuk meyakinkan pembaca akan kesimpulan yang diambil.
Konsep pH dan Pengukurannya
pH adalah ukuran keasaman atau kebasaan suatu larutan, yang dinyatakan dalam skala dari 0 hingga 14. Larutan dengan pH di bawah 7 bersifat asam, sedangkan larutan dengan pH di atas 7 bersifat basa. Larutan dengan pH 7 bersifat netral.
pH larutan dapat diukur menggunakan pH meter, kertas lakmus, atau indikator pH lainnya.
Persamaan Henderson-Hasselbalch
Persamaan Henderson-Hasselbalch digunakan untuk menghitung pH larutan asam lemah:
pH = pKa + log([A-]/[HA])
di mana:* pH adalah pH larutan
- pKa adalah konstanta disosiasi asam
- [A-] adalah konsentrasi ion basa konjugasi
- [HA] adalah konsentrasi asam lemah
Perhitungan pH Larutan CH3COOH 0,1 M
Konstanta disosiasi asam (pKa) untuk CH3COOH adalah 4, 76. Jika konsentrasi CH3COOH adalah 0,1 M, maka pH larutan dapat dihitung sebagai berikut:
pH = 4,76 + log([CH3COO-]/[CH3COOH])
Karena CH3COOH terdisosiasi sebagian, kita dapat mengasumsikan bahwa konsentrasi ion CH3COO- dan CH3COOH hampir sama. Dengan demikian, persamaan menjadi:
pH = 4,76 + log(1)
pH = 4,76
Larutan CH3COOH 0,1 M memiliki konstanta asam (Ka) sebesar 10^-5, sehingga pH larutan tersebut dapat dihitung menggunakan persamaan Ka = H+CH3COO-/CH3COOH. Di sisi lain, gaya hidup sehat merupakan aspek penting untuk menjaga kesejahteraan. Gambar baliho hidup sehat dapat menjadi media yang efektif untuk mempromosikan kebiasaan sehat dan meningkatkan kesadaran masyarakat akan pentingnya menjaga kesehatan.
Dengan menerapkan pola hidup sehat, individu dapat menjaga keseimbangan pH tubuh, termasuk pH larutan CH3COOH 0,1 M, yang penting untuk fungsi fisiologis yang optimal.
Oleh karena itu, pH larutan CH3COOH 0,1 M adalah 4,76.
Pengaruh Konsentrasi pada pH

Konsentrasi larutan asam asetat (CH 3COOH) berdampak signifikan pada nilai pH-nya. Semakin tinggi konsentrasi CH 3COOH, semakin rendah pH larutan.
Grafik Hubungan Konsentrasi CH3COOH dan pH
Grafik berikut menunjukkan hubungan antara konsentrasi CH 3COOH dan pH:

Perhitungan pH Larutan CH3COOH
pH larutan CH 3COOH dapat dihitung menggunakan persamaan berikut:
pH =
log[H+]
di mana [H +] adalah konsentrasi ion hidrogen dalam larutan.
Untuk larutan CH 3COOH 0,1 M dengan konstanta disosiasi asam (Ka) 1,8 x 10 -5, konsentrasi ion hidrogen dapat dihitung sebagai berikut:
Ka = [H+][CH 3COO –] / [CH 3COOH]
1,8 x 10-5= [H +] 2/ 0,1
[H+] = 1,34 x 10 -3M
Dengan demikian, pH larutan CH 3COOH 0,1 M adalah:
pH =
log(1,34 x 10-3) = 2,87
Aplikasi Larutan CH3COOH
Larutan CH3COOH (asam asetat) memiliki beragam aplikasi dalam kehidupan sehari-hari, industri, dan penelitian ilmiah.
Sebagai Bahan Pengawet
Sifat asam CH3COOH menghambat pertumbuhan bakteri dan jamur, menjadikannya bahan pengawet yang efektif dalam makanan dan minuman. Larutan CH3COOH digunakan dalam pembuatan acar, saus, dan minuman ringan untuk mencegah pembusukan.
Sebagai Penambah Rasa
Rasa asam CH3COOH menambah cita rasa pada makanan dan minuman. Larutan CH3COOH digunakan sebagai penambah rasa dalam cuka, saus salad, dan makanan yang difermentasi seperti kimchi dan sauerkraut.
Sebagai Pelarut
Larutan CH3COOH adalah pelarut yang baik untuk berbagai zat, termasuk minyak esensial, pewarna, dan bahan kimia organik. Dalam industri farmasi, larutan CH3COOH digunakan sebagai pelarut dalam pembuatan obat-obatan.
Akhir Kata

Sifat asam larutan CH3COOH 0,1 M memiliki berbagai aplikasi dalam kehidupan sehari-hari. Larutan ini dapat digunakan sebagai bahan pengawet dalam makanan dan minuman, penambah rasa dalam makanan, dan pelarut dalam berbagai proses industri. Pemahaman tentang sifat asam dan pH larutan CH3COOH sangat penting untuk memastikan penggunaan yang aman dan efektif dalam berbagai aplikasi ini.
Pertanyaan yang Sering Muncul
Apa itu larutan CH3COOH?
Larutan CH3COOH adalah larutan yang mengandung asam asetat (CH3COOH), juga dikenal sebagai asam cuka, terlarut dalam air.
Bagaimana cara menghitung pH larutan CH3COOH?
pH larutan CH3COOH dapat dihitung menggunakan persamaan Henderson-Hasselbalch: pH = pKa + log([A-]/[HA]), di mana pKa adalah konstanta disosiasi asam, [A-] adalah konsentrasi ion asetat, dan [HA] adalah konsentrasi asam asetat.
Apa saja aplikasi larutan CH3COOH?
Larutan CH3COOH memiliki berbagai aplikasi, termasuk sebagai bahan pengawet makanan, penambah rasa, dan pelarut dalam proses industri.
