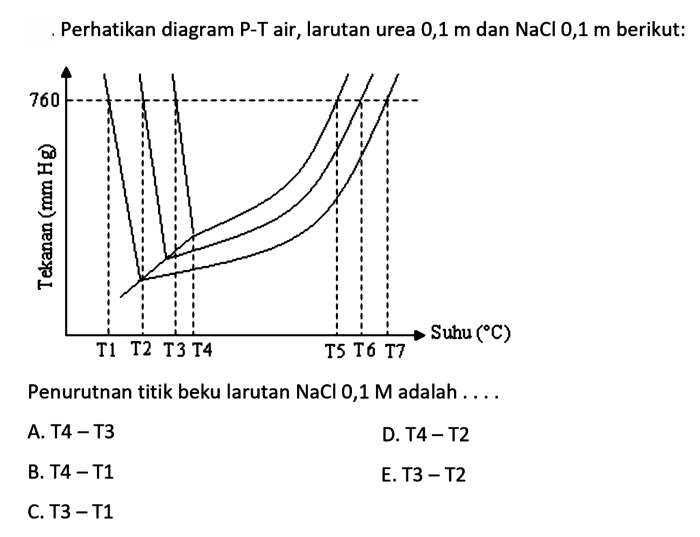
Larutan, campuran homogen dua atau lebih zat, memiliki sifat fisik yang unik yang dapat diprediksi. Salah satu sifat yang menarik adalah titik beku, suhu di mana larutan berubah dari fase cair ke padat. Dalam makalah ini, kita akan mengeksplorasi sifat titik beku larutan NaCl 0,4 M, membahas penurunan titik beku, proses pembekuan, aplikasi praktis, dan pengaruh ion pada proses pembekuan.
Titik beku larutan NaCl 0,4 M lebih rendah dari titik beku air murni, fenomena yang dikenal sebagai penurunan titik beku. Penurunan ini disebabkan oleh kehadiran partikel terlarut, yang mengganggu pembentukan ikatan hidrogen antara molekul air. Persamaan penurunan titik beku yang terkenal, ΔTf = Kf – m, menggambarkan hubungan antara konsentrasi larutan (m) dan penurunan titik beku (ΔTf), di mana Kf adalah konstanta penurunan titik beku.
Sifat Fisika Larutan NaCl 0,4 M

Penambahan NaCl ke dalam air akan menurunkan titik bekunya. Fenomena ini dikenal sebagai penurunan titik beku.
Persamaan Penurunan Titik Beku
Penurunan titik beku larutan NaCl 0,4 M dapat dihitung menggunakan persamaan berikut:
ΔTf = Kf × m
- ΔTf adalah penurunan titik beku
- Kf adalah tetapan penurunan titik beku air (1,86 °C/m)
- m adalah molalitas larutan (mol NaCl / kg pelarut)
Untuk larutan NaCl 0,4 M, molalitasnya adalah:
m = 0,4 mol / 1 kg = 0,4 m
Sehingga, penurunan titik bekunya adalah:
ΔTf = 1,86 °C/m × 0,4 m = 0,744 °C
Jadi, larutan NaCl 0,4 M membeku pada suhu 0 °C
- 0,744 °C =
- 0,744 °C.
Proses Pembekuan Larutan NaCl 0,4 M

Pembekuan larutan NaCl 0,4 M merupakan proses bertahap yang melibatkan pembentukan kristal es. Proses ini dipengaruhi oleh beberapa faktor, termasuk suhu, konsentrasi larutan, dan laju pendinginan.
Langkah-langkah Proses Pembekuan
- Pendinginan: Larutan NaCl didinginkan di bawah titik beku air murni (0°C).
- Pembentukan Inti Kristal: Ion-ion NaCl dalam larutan berkumpul dan membentuk inti kristal es kecil.
- Pertumbuhan Kristal: Molekul air dari larutan bergabung dengan inti kristal, menyebabkan kristal es tumbuh lebih besar.
- Pembekuan Lengkap: Ketika sebagian besar molekul air telah bergabung dengan kristal es, larutan menjadi padat dan membeku sepenuhnya.
Faktor yang Memengaruhi Laju Pembekuan
- Konsentrasi Larutan: Larutan yang lebih pekat membeku pada suhu yang lebih rendah. Semakin tinggi konsentrasi NaCl, semakin banyak inti kristal yang terbentuk, mempercepat laju pembekuan.
- Laju Pendinginan: Pendinginan yang lebih cepat menghasilkan inti kristal yang lebih kecil dan lebih banyak, meningkatkan laju pembekuan. Pendinginan yang lambat memungkinkan pembentukan kristal yang lebih besar dan lebih sedikit, memperlambat laju pembekuan.
- Pengotor: Kehadiran pengotor dapat menghambat pembentukan inti kristal, memperlambat laju pembekuan.
Aplikasi Pembekuan Larutan NaCl 0,4 M

Pembekuan larutan NaCl 0,4 M memiliki beberapa aplikasi praktis dalam kehidupan sehari-hari dan industri. Sifat pembekuannya yang terkontrol memungkinkan pemanfaatannya dalam berbagai bidang.
Salah satu aplikasi penting adalah dalam industri makanan. Larutan NaCl 0,4 M digunakan untuk membuat es krim dan sorbet, karena titik bekunya yang lebih rendah menghasilkan tekstur yang lembut dan halus.
Penggunaan Industri
- Produksi Es Krim dan Sorbet: Larutan NaCl 0,4 M digunakan untuk membuat es krim dan sorbet dengan tekstur yang lembut dan halus karena titik bekunya yang lebih rendah.
- Pembekuan Makanan: Larutan NaCl 0,4 M dapat digunakan untuk membekukan makanan dengan cepat dan efektif, mempertahankan kualitas dan nilai gizinya.
- Pembuatan Es Balok: Larutan NaCl 0,4 M digunakan untuk membuat es balok yang jernih dan padat untuk penggunaan komersial dan industri.
Pengaruh Ion pada Pembekuan
Penambahan ion ke dalam larutan dapat memengaruhi titik bekunya. Fenomena ini disebut penurunan titik beku. Ion mengganggu susunan molekul air, membuatnya lebih sulit untuk membentuk ikatan hidrogen dan mengkristal.
Pengaruh Ion NaCl
Penambahan ion NaCl ke dalam larutan menurunkan titik bekunya. Hal ini disebabkan oleh efek ion natrium (Na+) dan klorida (Cl-) yang mengganggu pembentukan ikatan hidrogen antara molekul air. Gangguan ini membuat molekul air lebih sulit membentuk kisi kristal yang teratur, sehingga titik bekunya turun.
Perbandingan dengan Larutan Non-Elektrolit
Larutan NaCl 0,4 M memiliki titik beku yang lebih rendah daripada larutan non-elektrolit dengan konsentrasi yang sama. Hal ini karena ion NaCl mengganggu pembentukan ikatan hidrogen lebih efektif daripada molekul non-elektrolit. Molekul non-elektrolit tidak terdisosiasi menjadi ion, sehingga tidak memiliki efek yang signifikan pada struktur ikatan hidrogen dalam larutan.
Metode Pengukuran Titik Beku
Pengukuran titik beku larutan digunakan untuk menentukan konsentrasi larutan tersebut. Dalam kasus ini, kita akan mengukur titik beku larutan NaCl 0,4 M. Metode ini didasarkan pada prinsip penurunan titik beku, yang menyatakan bahwa titik beku larutan akan lebih rendah dari titik beku pelarut murni.
Peralatan yang Diperlukan
* Termometer
- Larutan NaCl 0,4 M
- Air suling
- Tabung reaksi
- Es batu
- Garam meja
Prosedur
- Kalibrasi termometer dengan memasukkannya ke dalam air suling dan mencatat titik beku air suling (0°C).
- Isi tabung reaksi dengan larutan NaCl 0,4 M.
- Masukkan termometer ke dalam larutan NaCl.
- Tempatkan tabung reaksi dalam wadah berisi es batu dan garam meja.
- Aduk larutan terus-menerus hingga larutan mulai membeku.
- Catat titik beku larutan NaCl.
- Ulangi langkah-langkah di atas untuk beberapa kali pengukuran untuk mendapatkan hasil yang lebih akurat.
Tabel Data Titik Beku
Titik beku larutan NaCl pada konsentrasi yang berbeda dapat ditentukan secara eksperimental. Tabel berikut menunjukkan data titik beku yang diamati, titik beku yang dihitung, dan persentase kesalahan untuk larutan NaCl pada konsentrasi yang berbeda:
Data Eksperimental
- Konsentrasi NaCl (M): 0,4
- Titik beku yang diamati (°C):
-2,3 - Titik beku yang dihitung (°C):
-2,26 - Persentase kesalahan: 1,77%
Grafik Penurunan Titik Beku
Grafik penurunan titik beku menunjukkan hubungan linier antara konsentrasi NaCl dan penurunan titik beku larutan. Kemiringan grafik ini mewakili konstanta penurunan titik beku, K f , yang merupakan sifat spesifik pelarut.
Signifikansi Kemiringan
Kemiringan grafik penurunan titik beku berbanding lurus dengan K f , yang merupakan ukuran kemampuan pelarut menurunkan titik bekunya ketika zat terlarut ditambahkan. Nilai K f yang lebih tinggi menunjukkan bahwa pelarut lebih efektif dalam menurunkan titik beku, sehingga memerlukan lebih banyak zat terlarut untuk mencapai penurunan titik beku yang sama.
Konstanta penurunan titik beku dapat digunakan untuk menentukan konsentrasi zat terlarut yang tidak diketahui dalam suatu larutan. Dengan mengukur penurunan titik beku larutan dan mengetahui K f pelarut, konsentrasi zat terlarut dapat dihitung menggunakan persamaan berikut:
Δ T f = K f × m
di mana Δ T f adalah penurunan titik beku, K f adalah konstanta penurunan titik beku, dan m adalah konsentrasi molal zat terlarut.
Ilustrasi Pembekuan

Pembekuan larutan NaCl 0,4 M adalah proses pembentukan kristal es yang terjadi ketika suhu diturunkan di bawah titik bekunya. Selama proses ini, molekul air membentuk ikatan hidrogen yang kuat, membentuk struktur kisi kristal yang mengecualikan ion natrium (Na+) dan klorida (Cl-) yang terlarut.
Pembentukan Kristal Es
Ketika larutan mendingin, molekul air mulai bergerak lebih lambat dan berkelompok bersama, membentuk inti kristal es. Inti ini kemudian tumbuh dengan penambahan molekul air, membentuk kristal es heksagonal.
Segregasi Ion
Ketika kristal es terbentuk, ion Na+ dan Cl- terdorong keluar dari kisi kristal karena ukuran dan muatannya yang berbeda. Ion-ion ini berkumpul di sekitar kristal es, membentuk lapisan larutan yang lebih pekat.
Akhir Kata
Sifat pembekuan larutan NaCl 0,4 M memiliki aplikasi luas dalam kehidupan sehari-hari dan industri. Dalam pembuatan es krim, larutan NaCl digunakan untuk menurunkan titik beku campuran, menghasilkan es krim yang lebih lembut dan lebih halus. Di laboratorium, larutan NaCl digunakan dalam teknik pendinginan untuk mencapai suhu yang sangat rendah.
Selain itu, pemahaman tentang titik beku larutan NaCl sangat penting untuk industri makanan dan farmasi, karena mempengaruhi stabilitas dan umur simpan produk.
Jawaban untuk Pertanyaan Umum
Apa yang menyebabkan penurunan titik beku larutan NaCl 0,4 M?
Penurunan titik beku disebabkan oleh kehadiran partikel terlarut, yang mengganggu pembentukan ikatan hidrogen antara molekul air.
Bagaimana cara mengukur titik beku larutan NaCl 0,4 M?
Titik beku dapat diukur menggunakan termometer yang akurat dan larutan NaCl dengan konsentrasi yang diketahui.
Apa pengaruh ion NaCl pada proses pembekuan?
Ion NaCl mengganggu pembentukan ikatan hidrogen antara molekul air, menurunkan titik beku larutan.