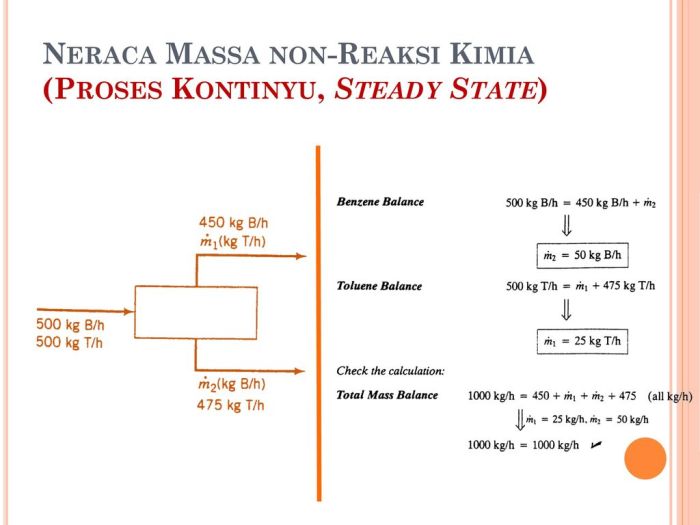
Dalam dunia reaksi kimia, neraca massa berperan penting dalam mengungkap misteri transformasi bahan. Ini adalah prinsip dasar yang memungkinkan kita melacak pergerakan dan perubahan materi selama reaksi kimia yang kompleks. Dengan memahami konsep ini, kita dapat memperoleh wawasan yang tak ternilai tentang bagaimana zat bereaksi, berubah, dan berkontribusi pada berbagai proses alam dan industri.
Neraca massa didasarkan pada hukum kekekalan massa, yang menyatakan bahwa dalam sistem tertutup, massa total tetap konstan selama reaksi kimia. Dengan menerapkan hukum ini pada reaksi kimia, kita dapat membuat persamaan yang menyamakan massa reaktan yang masuk dengan massa produk yang dihasilkan.
Persamaan ini menjadi dasar untuk memahami dan memprediksi hasil reaksi kimia, serta mengoptimalkan proses industri.
Pengertian Neraca Massa dengan Reaksi Kimia

Neraca massa adalah prinsip dasar yang menyatakan bahwa massa total dalam sistem tertutup tetap konstan, tidak peduli perubahan yang terjadi dalam sistem tersebut. Dalam reaksi kimia, neraca massa digunakan untuk melacak jumlah reaktan dan produk yang terlibat dalam reaksi.
Untuk membuat neraca massa reaksi kimia, kita perlu menyeimbangkan persamaan kimia. Persamaan kimia yang seimbang menunjukkan jumlah relatif reaktan dan produk yang bereaksi dan terbentuk. Setelah persamaan seimbang, kita dapat menggunakan koefisien stoikiometri untuk menghitung massa masing-masing reaktan dan produk yang terlibat dalam reaksi.
Contoh Neraca Massa Reaksi Kimia
Sebagai contoh, perhatikan reaksi pembakaran metana berikut:
CH₄ + 2O₂ → CO₂ + 2H₂O
Persamaan kimia ini menunjukkan bahwa satu molekul metana (CH₄) bereaksi dengan dua molekul oksigen (2O₂) untuk menghasilkan satu molekul karbon dioksida (CO₂) dan dua molekul air (2H₂O).
Untuk membuat neraca massa, kita perlu mengetahui massa molar dari masing-masing reaktan dan produk:
* Massa molar CH₄ = 16 g/mol
- Massa molar O₂ = 32 g/mol
- Massa molar CO₂ = 44 g/mol
- Massa molar H₂O = 18 g/mol
Sekarang, kita dapat menghitung massa masing-masing reaktan dan produk yang terlibat dalam reaksi:
* Massa 1 mol CH₄ = 16 g
- Massa 2 mol O₂ = 64 g
- Massa 1 mol CO₂ = 44 g
- Massa 2 mol H₂O = 36 g
Berdasarkan neraca massa, kita dapat menyimpulkan bahwa 16 g metana bereaksi dengan 64 g oksigen untuk menghasilkan 44 g karbon dioksida dan 36 g air.
Penerapan Neraca Massa
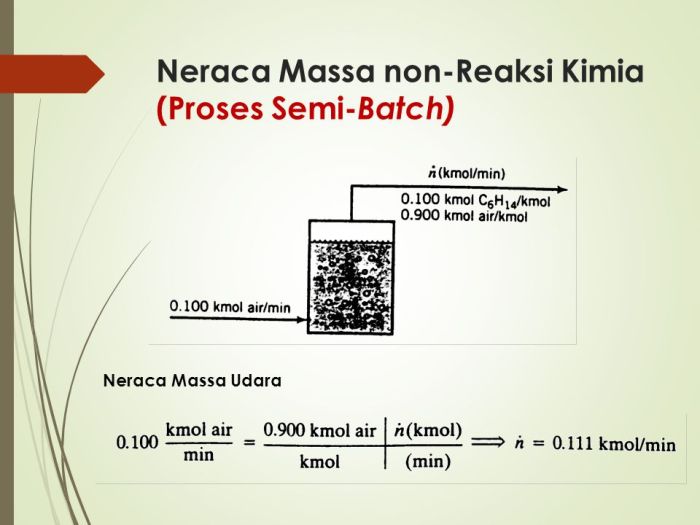
Neraca massa merupakan alat yang sangat penting dalam berbagai bidang, termasuk industri kimia, lingkungan, dan biologi. Neraca massa digunakan untuk menganalisis, merancang, dan mengoptimalkan proses yang melibatkan perubahan komposisi atau jumlah materi.
Dalam industri kimia, neraca massa digunakan untuk menghitung hasil reaksi, mengoptimalkan proses produksi, dan mendesain reaktor kimia. Dalam bidang lingkungan, neraca massa digunakan untuk memodelkan polusi udara dan air, serta untuk merancang sistem pengolahan limbah. Dalam biologi, neraca massa digunakan untuk menganalisis metabolisme sel dan untuk mendesain bioreaktor.
Contoh Kasus Penggunaan Neraca Massa
- Mendesain reaktor kimia untuk memproduksi bahan kimia tertentu
- Memprediksi emisi polusi udara dari pembangkit listrik
- Mengoptimalkan proses pengolahan air limbah untuk mengurangi polusi air
- Menganalisis metabolisme sel untuk mengidentifikasi jalur metabolik yang penting
- Mendesain bioreaktor untuk produksi obat-obatan atau bahan kimia lainnya
Prosedur Penyusunan Neraca Massa
Penyusunan neraca massa melibatkan langkah-langkah sistematis untuk menentukan distribusi massa dalam suatu sistem reaksi kimia. Prosedur ini membantu mengidentifikasi aliran massa, menentukan efisiensi reaksi, dan memprediksi perilaku sistem.
Langkah-Langkah Penyusunan Neraca Massa
- Definisi Sistem: Tentukan batas sistem dan identifikasi semua aliran massa yang masuk dan keluar.
- Penentuan Reaksi Kimia: Tulis persamaan reaksi kimia yang mewakili proses yang terjadi.
- Penyusunan Persamaan Neraca Massa: Untuk setiap komponen dalam sistem, susun persamaan neraca massa yang menyatakan bahwa massa yang masuk sama dengan massa yang keluar ditambah akumulasi massa.
- Pengumpulan Data: Kumpulkan data tentang aliran massa, konsentrasi, dan laju reaksi untuk semua aliran yang masuk dan keluar.
- Penyelesaian Persamaan: Selesaikan persamaan neraca massa untuk menentukan aliran massa yang tidak diketahui.
- Verifikasi: Verifikasi hasil dengan membandingkan aliran massa yang dihitung dengan pengukuran aktual atau nilai teoretis.
Tabel Neraca Massa
Tabel neraca massa digunakan untuk mencatat data yang diperlukan dan menghitung aliran massa. Tabel ini berisi kolom-kolom berikut:
- Komponen
- Aliran Masuk
- Aliran Keluar
- Akumulasi
- Aliran Massa (dihitung)
Dengan menggunakan tabel ini, penyusunan neraca massa dapat dilakukan secara sistematis dan efisien.
Contoh dan Studi Kasus

Neraca massa banyak diterapkan dalam berbagai sistem reaksi kimia untuk menentukan kuantitas reaktan dan produk yang terlibat. Berikut adalah beberapa contoh dan studi kasus yang menunjukkan penerapan neraca massa:
Studi Kasus: Pembakaran Metana
Dalam pembakaran metana, CH4, dengan oksigen, O2, neraca massa digunakan untuk menentukan kuantitas oksigen yang dibutuhkan untuk membakar sejumlah metana tertentu. Reaksi kimia yang terjadi adalah:
CH4 + 2O2 → CO2 + 2H2O
Dengan menggunakan neraca massa, dapat ditentukan bahwa untuk membakar 1 mol metana, diperlukan 2 mol oksigen. Studi kasus ini menunjukkan bagaimana neraca massa dapat digunakan untuk mengoptimalkan proses pembakaran dan memastikan pembakaran yang lengkap.
Contoh: Reaksi Asam-Basa
Dalam reaksi asam-basa antara asam klorida, HCl, dan natrium hidroksida, NaOH, neraca massa digunakan untuk menentukan konsentrasi produk yang dihasilkan. Reaksi kimianya adalah:
HCl + NaOH → NaCl + H2O
Dengan menggunakan neraca massa, dapat ditentukan bahwa 1 mol HCl akan bereaksi dengan 1 mol NaOH, menghasilkan 1 mol NaCl dan 1 mol H2O. Contoh ini menunjukkan bagaimana neraca massa dapat digunakan untuk memprediksi hasil reaksi dan menentukan konsentrasi produk.
Aplikasi Industri
Neraca massa banyak digunakan dalam industri kimia untuk mengoptimalkan proses produksi, meminimalkan limbah, dan memastikan keselamatan. Misalnya, dalam industri petrokimia, neraca massa digunakan untuk menyeimbangkan reaksi kimia dalam reaktor dan menentukan kuantitas bahan baku yang dibutuhkan untuk menghasilkan produk yang diinginkan.
Ringkasan Penutup

Secara keseluruhan, neraca massa dengan reaksi kimia adalah alat yang ampuh yang memberdayakan kita untuk menguraikan transformasi bahan kimia yang tak terhitung banyaknya. Dengan memahami prinsip-prinsipnya dan menerapkannya pada sistem dunia nyata, kita dapat memperoleh wawasan yang berharga tentang dunia kita dan mengembangkan solusi untuk berbagai tantangan, mulai dari produksi bahan kimia yang efisien hingga perlindungan lingkungan.
Jawaban untuk Pertanyaan Umum
Apa itu neraca massa?
Neraca massa adalah teknik yang digunakan untuk melacak pergerakan dan perubahan massa selama proses atau reaksi kimia.
Mengapa neraca massa penting dalam reaksi kimia?
Neraca massa memungkinkan kita untuk memahami dan memprediksi hasil reaksi kimia, serta mengoptimalkan proses industri dengan memastikan bahwa massa total tetap konstan.
Apa saja penerapan neraca massa?
Neraca massa diterapkan dalam berbagai bidang, termasuk industri kimia, lingkungan, dan biologi, untuk memecahkan masalah praktis seperti optimalisasi proses, penilaian dampak lingkungan, dan desain reaktor kimia.
Apa saja batasan dan pertimbangan saat menggunakan neraca massa?
Batasan dan pertimbangan meliputi asumsi yang dibuat, kemungkinan kesalahan, dan ketersediaan data yang akurat.