Perhatikan persamaan reaksi benzena berikut, sebuah senyawa aromatik yang menjadi dasar bagi berbagai reaksi kimia penting. Benzena, dengan struktur cincin enam karbonnya yang stabil, menunjukkan reaktivitas unik yang membuka jalan bagi berbagai transformasi kimia.
Dari substitusi elektrofilik hingga adisi elektrofilik, reduksi hingga oksidasi, dan pembentukan hingga pemecahan ikatan C-C, benzena menjadi subjek eksplorasi yang menarik dalam kimia organik.
Reaksi Substitusi Elektrofilik Aromatik
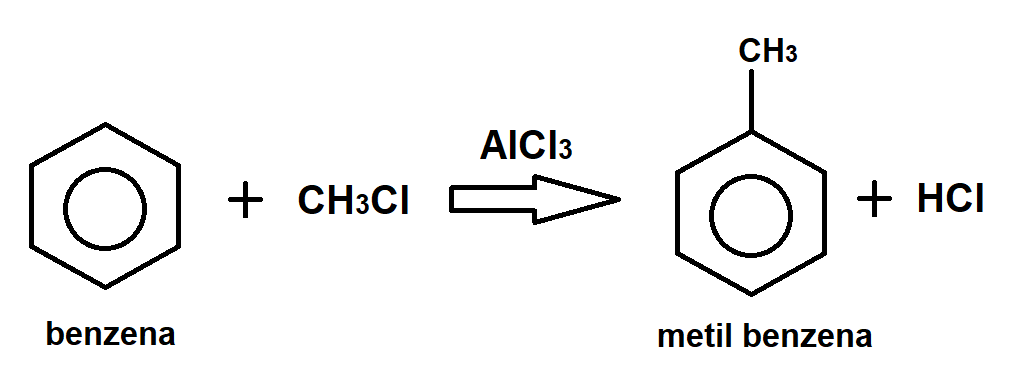
Reaksi substitusi elektrofilik aromatik adalah reaksi kimia penting yang melibatkan penggantian atom hidrogen pada cincin benzena dengan gugus elektrofilik. Reaksi ini banyak digunakan dalam industri kimia untuk menghasilkan berbagai senyawa organik, termasuk obat-obatan, pewarna, dan plastik.
Mekanisme reaksi substitusi elektrofilik aromatik terjadi melalui pembentukan kompleks elektrofilik, yang kemudian menyerang cincin benzena dan menggantikan atom hidrogen.
Contoh Reaksi Substitusi Elektrofilik Aromatik
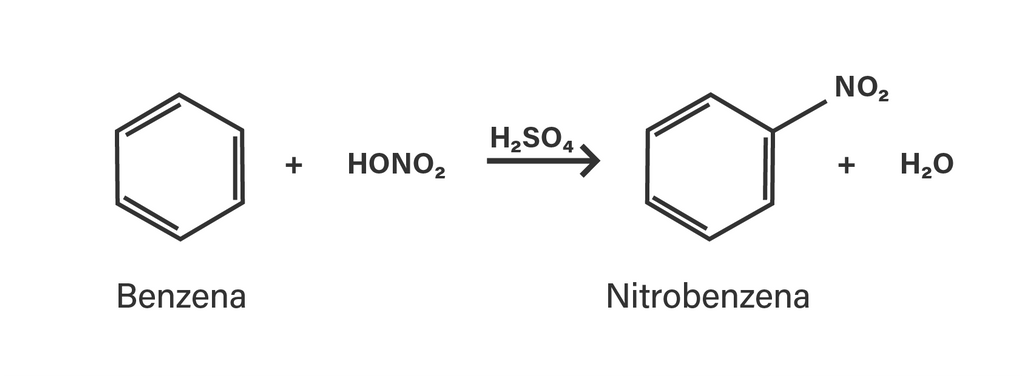
- Nitrasi benzena: Reaksi antara benzena dan asam nitrat pekat menghasilkan nitrobenzena.
- Sulfonasi benzena: Reaksi antara benzena dan asam sulfat pekat menghasilkan benzenasulfonat.
- Alkilasi benzena: Reaksi antara benzena dan alkil halida menghasilkan alkilbenzena.
Pengaruh Gugus Pengarah pada Reaktivitas Cincin Benzena
Gugus pengarah adalah gugus yang terikat pada cincin benzena dan dapat mempengaruhi reaktivitas cincin tersebut. Gugus pengarah dapat menjadi pengarah orto/para (mempercepat reaksi pada posisi orto dan para) atau pengarah meta (memperlambat reaksi pada posisi orto dan para).
- Pengarah orto/para: Gugus -NH 2, -OH, -CH 3
- Pengarah meta: Gugus -NO 2, -COOH, -SO 3H
Reaksi Adisi Elektrofilik Aromatik
Reaksi adisi elektrofilik aromatik adalah reaksi kimia di mana elektrofil (spesies yang kekurangan elektron) ditambahkan ke cincin benzena, menghasilkan senyawa baru yang mengandung cincin sikloheksena.
Mekanisme Reaksi
Mekanisme reaksi adisi elektrofilik aromatik melibatkan tiga langkah utama:
- Pembentukan elektrofil: Elektrofil, seperti ion hidrogen (H+), dihasilkan dari suatu asam atau basa Lewis.
- Penyerangan pada cincin benzena: Elektrofil menyerang cincin benzena, membentuk ikatan rangkap antara karbon cincin dan elektrofil.
- Penambahan basa: Basa, seperti air (H2O) atau hidroksida (OH-), mentransfer proton ke atom karbon yang baru saja terikat dengan elektrofil, menghasilkan senyawa sikloheksena.
Contoh Reaksi
Salah satu contoh umum reaksi adisi elektrofilik aromatik adalah nitrasi benzena, di mana ion nitronium (NO2+) ditambahkan ke cincin benzena untuk menghasilkan nitrobenzena.
Faktor-faktor yang Mempengaruhi Reaktivitas
Reaktivitas cincin benzena dalam reaksi adisi elektrofilik dipengaruhi oleh beberapa faktor, termasuk:
- Pengganti cincin: Pengganti elektron-donor (seperti gugus alkil) meningkatkan reaktivitas, sedangkan pengganti penarik elektron (seperti gugus nitro) menurunkannya.
- Keasaman elektrofil: Elektrofil yang lebih asam lebih reaktif.
- Kekuatan basa: Basa yang lebih kuat mempercepat reaksi.
Reaksi Redoks Aromatik
Reaksi redoks aromatik melibatkan oksidasi atau reduksi cincin benzena. Reaksi ini memainkan peran penting dalam sintesis organik dan industri kimia.
Mekanisme Reaksi Reduksi
Reduksi cincin benzena biasanya dilakukan dengan katalis logam seperti nikel, paladium, atau platinum. Hidrogen (H 2) bertindak sebagai reduktor, menambahkan ke ikatan rangkap C=C pada cincin benzena. Proses ini dikenal sebagai hidrogenasi dan menghasilkan sikloheksana.
Dalam reaksi kimia, persamaan reaksi benzena menjadi perhatian penting. Sebagai contoh, dalam pembuatan thai tea, diperlukan perjanjian franchise yang jelas. Contoh surat perjanjian franchise thai tea dapat membantu mengatur hak dan kewajiban kedua belah pihak. Dengan demikian, persamaan reaksi benzena dapat diterapkan dalam berbagai aspek, termasuk bidang bisnis dan hukum.
Mekanisme Reaksi Oksidasi
Oksidasi cincin benzena dapat terjadi melalui berbagai mekanisme. Salah satu mekanisme umum adalah oksidasi elektrofilik, di mana elektrofil seperti ion permanganat (MnO 4–) atau dikromat (Cr 2O 72-) menyerang cincin benzena, membentuk senyawa intermediat yang disebut fenol.
Contoh Reaksi Reduksi
* Hidrogenasi benzena menjadi sikloheksana
Reduksi nitrobenzena menjadi anilin
Perhatikan persamaan reaksi benzena berikut. Reaksi ini menggambarkan konversi benzena menjadi senyawa yang lebih kompleks. Senyawa yang dihasilkan dapat bervariasi tergantung pada kondisi reaksi, seperti suhu dan katalis. Selain reaksi kimia, terdapat aktivitas fisik seperti senam lantai yang melibatkan gerakan dinamis.
Berikut ini merupakan senam lantai kecuali handstand dan kayang, yang membutuhkan kekuatan dan keseimbangan yang signifikan. Namun, kembali pada reaksi benzena, konversi ini sangat penting dalam industri kimia, karena memungkinkan produksi berbagai bahan kimia yang digunakan dalam produk sehari-hari.
Contoh Reaksi Oksidasi
* Oksidasi benzena menjadi fenol
Oksidasi toluena menjadi asam benzoat
Aplikasi Reaksi Redoks Aromatik
Reaksi redoks aromatik memiliki berbagai aplikasi dalam sintesis organik, termasuk:* Produksi bahan bakar dan pelumas
- Pembuatan obat-obatan dan bahan kimia pertanian
- Sintesis pewarna dan polimer
Reaksi Pembentukan dan Pemecahan Ikatan C-C Aromatik

Ikatan C-C aromatik merupakan ikatan kovalen antara dua atom karbon dalam sistem aromatik, seperti benzena. Ikatan ini memiliki karakteristik khusus yang membedakannya dari ikatan C-C alifatik.
Dalam persamaan reaksi benzena, pola substitusi gugus fungsi pada cincin benzena dapat diprediksi menggunakan rumus dari pola bilangan 4 9 14 19 adalah di sini . Rumus ini menyatakan bahwa jumlah substituen pada posisi orto (1,2), meta (1,3), dan para (1,4) terhadap gugus fungsi pertama mengikuti pola bilangan tersebut.
Dengan memahami pola ini, kita dapat memprediksi produk reaksi substitusi benzena dengan lebih akurat, sehingga memungkinkan sintesis senyawa organik yang ditargetkan dengan lebih efisien.
Mekanisme Reaksi Pembentukan Ikatan C-C Aromatik
Pembentukan ikatan C-C aromatik umumnya terjadi melalui reaksi sikloadisi atau reaksi elektrofilik aromatik. Reaksi sikloadisi melibatkan penambahan 1,3-diena atau alkena lain ke dalam sistem aromatik, membentuk siklus baru dengan ikatan C-C aromatik. Reaksi elektrofilik aromatik, di sisi lain, melibatkan serangan elektrofil (seperti ion nitronium) pada cincin aromatik, yang mengarah pada pembentukan ikatan C-C aromatik baru.
Mekanisme Reaksi Pemecahan Ikatan C-C Aromatik
Pemecahan ikatan C-C aromatik dapat terjadi melalui berbagai mekanisme, termasuk reaksi eliminasi, reaksi substitusi, dan reaksi redoks. Reaksi eliminasi melibatkan pemutusan ikatan C-C dan pembentukan ikatan rangkap, sedangkan reaksi substitusi melibatkan penggantian satu atom atau gugus fungsi dengan yang lain.
Reaksi redoks, di sisi lain, melibatkan perubahan bilangan oksidasi atom karbon yang terlibat dalam ikatan C-C aromatik.
Aplikasi Reaksi Pembentukan dan Pemecahan Ikatan C-C Aromatik dalam Sintesis Organik
Reaksi pembentukan dan pemecahan ikatan C-C aromatik sangat penting dalam sintesis organik. Reaksi ini digunakan untuk membuat berbagai senyawa organik, termasuk obat-obatan, bahan kimia pertanian, dan pewarna. Misalnya, reaksi Diels-Alder, yang merupakan jenis reaksi sikloadisi, digunakan untuk membuat sikloheksena, yang merupakan bahan awal untuk produksi nilon.
Reaksi Heterosiklik Aromatik
Cincin heterosiklik aromatik adalah senyawa organik yang mengandung cincin benzena dengan satu atau lebih atom heteroatom (atom selain karbon atau hidrogen) di dalam cincin.
Sifat Kimia dan Reaktivitas
Cincin heterosiklik aromatik memiliki sifat aromatik karena sistem cincin datar dan konjugasi elektron pi. Sifat aromatik ini memberikan stabilitas dan reaktivitas unik.
Reaksi, Perhatikan persamaan reaksi benzena berikut
Cincin heterosiklik aromatik dapat bereaksi melalui berbagai mekanisme, termasuk:
- Reaksi Elektrofilik Aromatik:Cincin heterosiklik aromatik dapat bereaksi dengan elektrofil, seperti H +, NO 2+, dan SO 3H, pada posisi alfa terhadap atom heteroatom.
- Reaksi Nukleofilik Aromatik:Cincin heterosiklik aromatik yang kekurangan elektron dapat bereaksi dengan nukleofil, seperti NH 2–, OR –, dan SR –, pada posisi orto dan para terhadap atom heteroatom.
- Reaksi Sisi Rantai:Cincin heterosiklik aromatik dapat mengalami reaksi sisi rantai pada gugus fungsi yang terikat pada atom heteroatom.
Simpulan Akhir
Memahami persamaan reaksi benzena tidak hanya penting untuk apresiasi terhadap kimia organik tetapi juga memiliki implikasi luas dalam pengembangan obat-obatan, bahan polimer, dan bahan kimia industri lainnya. Reaksi-reaksi ini membentuk dasar bagi sintesis berbagai senyawa yang memainkan peran penting dalam kehidupan kita sehari-hari.
Kumpulan Pertanyaan Umum: Perhatikan Persamaan Reaksi Benzena Berikut
Apa itu reaksi substitusi elektrofilik aromatik?
Reaksi substitusi elektrofilik aromatik adalah proses penggantian atom hidrogen pada cincin benzena dengan gugus elektrofilik (kaya elektron).
Bagaimana reaktivitas cincin benzena dipengaruhi oleh gugus pengarah?
Gugus pengarah dapat meningkatkan atau menurunkan reaktivitas cincin benzena tergantung pada sifatnya (donor atau penarik elektron).
Sebutkan aplikasi reaksi redoks aromatik.
Reaksi redoks aromatik digunakan dalam sintesis berbagai senyawa, seperti obat-obatan, pewarna, dan bahan bakar.