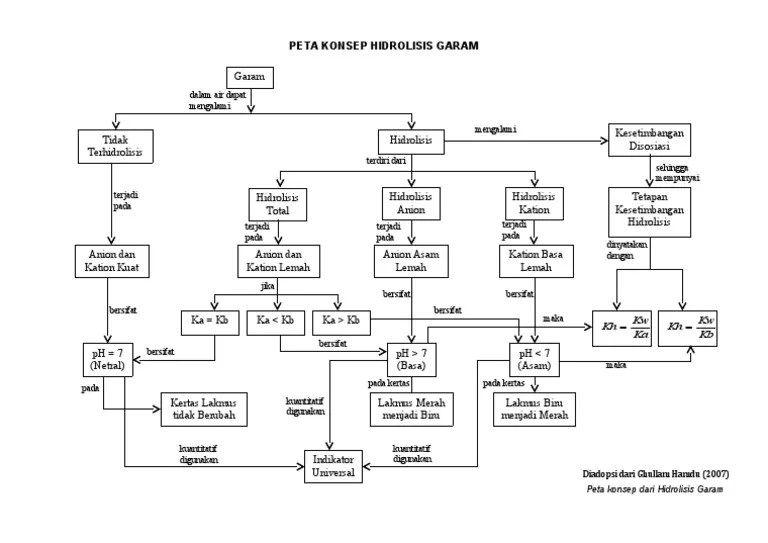
Hidrolisis garam merupakan fenomena kimia penting yang melibatkan interaksi ionik antara garam dan air. Proses ini memiliki implikasi yang luas dalam berbagai bidang, mulai dari biologi hingga industri.
Peta konsep berikut menyajikan pandangan komprehensif tentang hidrolisis garam, menguraikan konsep-konsep utama, faktor-faktor yang memengaruhi, dan implikasinya pada sifat larutan.
Definisi dan Jenis Hidrolisis Garam
Hidrolisis garam adalah reaksi kimia yang terjadi antara ion garam dengan air, menghasilkan asam dan basa.
Hidrolisis garam dapat diklasifikasikan berdasarkan jenis garam dan derajat hidrolisisnya:
Klasifikasi Berdasarkan Jenis Garam
- Garam netral: Garam yang terbentuk dari asam kuat dan basa kuat, tidak terhidrolisis.
- Garam asam: Garam yang terbentuk dari asam kuat dan basa lemah, terhidrolisis sebagian, menghasilkan asam lemah dan basa kuat.
- Garam basa: Garam yang terbentuk dari asam lemah dan basa kuat, terhidrolisis sebagian, menghasilkan asam lemah dan basa kuat.
Klasifikasi Berdasarkan Derajat Hidrolisis
- Hidrolisis sempurna: Garam yang terhidrolisis sempurna menjadi asam dan basa, menghasilkan larutan netral.
- Hidrolisis sebagian: Garam yang terhidrolisis sebagian, menghasilkan larutan asam atau basa.
- Hidrolisis tidak terjadi: Garam yang tidak terhidrolisis sama sekali.
Faktor-Faktor yang Mempengaruhi Hidrolisis Garam
Hidrolisis garam dipengaruhi oleh beberapa faktor, termasuk kekuatan asam dan basa penyusun garam, konsentrasi garam, dan suhu.
Pengaruh Kekuatan Asam dan Basa Penyusun Garam
Kekuatan asam dan basa penyusun garam menentukan sejauh mana garam akan terhidrolisis. Garam yang terbentuk dari asam kuat dan basa lemah akan terhidrolisis lebih luas dibandingkan garam yang terbentuk dari asam lemah dan basa kuat.
- Garam Asam Kuat dan Basa Lemah: Garam ini akan terhidrolisis menghasilkan larutan asam karena ion hidrogen (H+) dari asam kuat akan lebih mudah bereaksi dengan air daripada ion hidroksida (OH-) dari basa lemah.
- Garam Asam Lemah dan Basa Kuat: Garam ini akan terhidrolisis menghasilkan larutan basa karena ion hidroksida (OH-) dari basa kuat akan lebih mudah bereaksi dengan air daripada ion hidrogen (H+) dari asam lemah.
- Garam Asam Kuat dan Basa Kuat: Garam ini umumnya tidak terhidrolisis karena kekuatan asam dan basa penyusunnya seimbang.
- Garam Asam Lemah dan Basa Lemah: Garam ini umumnya terhidrolisis sedikit karena kekuatan asam dan basa penyusunnya lemah.
Pengaruh Konsentrasi Garam
Konsentrasi garam juga mempengaruhi tingkat hidrolisis. Semakin tinggi konsentrasi garam, semakin sedikit garam yang terhidrolisis. Hal ini karena ion-ion dalam larutan akan lebih cenderung berinteraksi satu sama lain daripada dengan molekul air.
Pengaruh Suhu
Suhu juga mempengaruhi tingkat hidrolisis. Pada umumnya, hidrolisis garam akan meningkat seiring dengan peningkatan suhu. Hal ini karena peningkatan suhu akan meningkatkan energi kinetik molekul, sehingga lebih mudah bereaksi satu sama lain.
Konstanta Hidrolisis (Kh)
Konstanta hidrolisis (Kh) adalah nilai numerik yang mengukur sejauh mana garam terhidrolisis dalam larutan. Ini menunjukkan kecenderungan garam untuk terpecah menjadi ion-ion penyusunnya, menghasilkan ion H + atau OH – .
Nilai Kh dapat dihitung menggunakan rumus:
Kh = [H + ][OH – ]/[Garam]
di mana:
- [H+] adalah konsentrasi ion hidrogen dalam larutan
- [OH–] adalah konsentrasi ion hidroksida dalam larutan
- [Garam] adalah konsentrasi garam dalam larutan
Nilai Kh dipengaruhi oleh beberapa faktor, termasuk:
- Sifat garam: Garam yang terbentuk dari asam lemah dan basa kuat memiliki Kh yang lebih besar, menunjukkan hidrolisis yang lebih ekstensif.
- Konsentrasi garam: Semakin tinggi konsentrasi garam, semakin kecil nilai Kh, menunjukkan penurunan hidrolisis.
- Suhu: Hidrolisis umumnya meningkat seiring dengan peningkatan suhu.
Produk Hidrolisis Garam
Hidrolisis garam mengacu pada reaksi antara garam dan air, menghasilkan pembentukan asam, basa, atau keduanya.
Produk hidrolisis garam bergantung pada jenis garam:
Garam Asam Kuat dan Basa Kuat
Garam yang terbentuk dari asam kuat dan basa kuat menghasilkan larutan netral karena tidak bereaksi dengan air.
Garam Asam Kuat dan Basa Lemah
Garam yang terbentuk dari asam kuat dan basa lemah menghasilkan larutan asam karena ion hidrogen dari air bereaksi dengan ion basa lemah, menghasilkan asam lemah.
Garam Asam Lemah dan Basa Kuat
Garam yang terbentuk dari asam lemah dan basa kuat menghasilkan larutan basa karena ion hidroksida dari air bereaksi dengan ion asam lemah, menghasilkan basa lemah.
Garam Asam Lemah dan Basa Lemah
Garam yang terbentuk dari asam lemah dan basa lemah menghasilkan larutan yang dapat sedikit asam, basa, atau netral, tergantung pada kekuatan relatif asam dan basa.
Pengaruh Hidrolisis Garam pada Sifat Larutan
Hidrolisis garam adalah reaksi antara ion garam dengan air, yang menghasilkan pembentukan asam atau basa lemah dan memengaruhi sifat larutan.
Pengaruh pada pH Larutan
Garam yang terbentuk dari asam lemah dan basa kuat akan mengalami hidrolisis menghasilkan larutan basa. Sebaliknya, garam yang terbentuk dari asam kuat dan basa lemah akan mengalami hidrolisis menghasilkan larutan asam.
Pengaruh pada Konduktivitas Listrik
Hidrolisis garam menghasilkan ion H+ atau OH-, yang dapat meningkatkan konduktivitas listrik larutan. Semakin besar tingkat hidrolisis, semakin tinggi konduktivitas listrik larutan.
Peta Konsep Hidrolisis Garam

Hidrolisis garam adalah reaksi kimia yang terjadi ketika garam dilarutkan dalam air, menghasilkan ion-ion penyusunnya dan mempengaruhi pH larutan. Peta konsep berikut mengilustrasikan hubungan antara konsep-konsep utama yang terkait dengan hidrolisis garam:
Jenis Hidrolisis Garam
- Hidrolisis Asam: Terjadi ketika anion garam adalah basa lemah dan menghasilkan larutan asam.
- Hidrolisis Basa: Terjadi ketika kation garam adalah asam lemah dan menghasilkan larutan basa.
- Hidrolisis Netral: Terjadi ketika baik anion maupun kation garam tidak mengalami hidrolisis dan tidak mempengaruhi pH larutan.
Faktor yang Mempengaruhi Hidrolisis Garam
- Kekuatan Asam dan Basa Penyusun Garam: Semakin lemah asam atau basa penyusun garam, semakin besar tingkat hidrolisis.
- Konsentrasi Garam: Semakin tinggi konsentrasi garam, semakin besar tingkat hidrolisis.
- Suhu: Hidrolisis garam biasanya meningkat dengan kenaikan suhu.
Produk Hidrolisis Garam
Produk hidrolisis garam adalah ion-ion penyusun garam dan air. Dalam hidrolisis asam, ion H+ diproduksi, sedangkan dalam hidrolisis basa, ion OH- diproduksi.
Pengaruh Hidrolisis Garam pada Larutan
- Pengaruh pada pH: Hidrolisis asam menurunkan pH larutan, sedangkan hidrolisis basa meningkatkan pH larutan.
- Pengaruh pada Konduktivitas Listrik: Hidrolisis garam meningkatkan konduktivitas listrik larutan karena ion-ion yang dihasilkan dari hidrolisis dapat menghantarkan listrik.
Contoh dan Penerapan Hidrolisis Garam

Hidrolisis garam memiliki banyak aplikasi praktis dalam kehidupan sehari-hari, industri, dan pengobatan.
Contoh dalam Kehidupan Sehari-hari
- Sabun dan deterjen adalah garam yang terhidrolisis dalam air, menghasilkan ion sabun yang memiliki sifat pembersih.
- Pembentukan karat pada besi adalah contoh hidrolisis garam besi, menghasilkan senyawa besi hidroksida yang berwarna cokelat kemerahan.
- Pembuatan air kapur (kalsium hidroksida) melalui reaksi hidrolisis garam kalsium oksida (kapur tohor).
Aplikasi Praktis
- Industri: Hidrolisis garam digunakan dalam pembuatan berbagai bahan kimia, seperti asam klorida, asam sulfat, dan natrium hidroksida.
- Pengolahan Air: Hidrolisis garam memainkan peran penting dalam proses pengolahan air, seperti pelunakan air dan menghilangkan ion logam berat.
- Pengobatan: Hidrolisis garam digunakan dalam produksi obat-obatan, seperti antasida dan obat pencahar.
Pemungkas

Memahami peta konsep hidrolisis garam sangat penting untuk memahami reaksi kimia yang kompleks dan aplikasinya dalam berbagai bidang. Peta konsep ini menyediakan alat yang berharga untuk menavigasi topik ini, memungkinkan pemahaman yang lebih dalam dan aplikasi praktisnya.
Pertanyaan Umum yang Sering Muncul
Apa saja jenis utama hidrolisis garam?
Hidrolisis garam diklasifikasikan menjadi hidrolisis sempurna, parsial, dan tidak terjadi, tergantung pada kekuatan asam dan basa penyusun garam.
Bagaimana suhu memengaruhi tingkat hidrolisis garam?
Peningkatan suhu umumnya meningkatkan tingkat hidrolisis garam karena meningkatkan energi kinetik ion.
Apa peran konstanta hidrolisis (Kh) dalam hidrolisis garam?
Konstanta hidrolisis (Kh) adalah ukuran kekuatan hidrolisis garam dan menentukan sejauh mana garam terhidrolisis dalam larutan.