Dalam kimia, reaksi ionisasi asam basa memainkan peran penting dalam banyak proses alam dan industri. Reaksi-reaksi ini melibatkan transfer proton, yang berdampak signifikan pada sifat kimiawi suatu zat. Memahami konsep dan aplikasi reaksi ionisasi asam basa sangat penting untuk menghargai dasar-dasar kimia.
Asam dan basa, komponen utama reaksi ionisasi, diklasifikasikan berdasarkan kemampuannya mentransfer proton. Reaksi ini tidak hanya memberikan wawasan tentang sifat kimiawi, tetapi juga memiliki implikasi praktis dalam berbagai bidang.
Reaksi Ionisasi Asam Basa
Reaksi ionisasi asam basa adalah reaksi kimia yang melibatkan transfer proton (ion hidrogen, H+) antara dua spesies kimia. Reaksi ini memainkan peran penting dalam banyak proses biologis dan kimia.
Konsep Reaksi Ionisasi Asam Basa
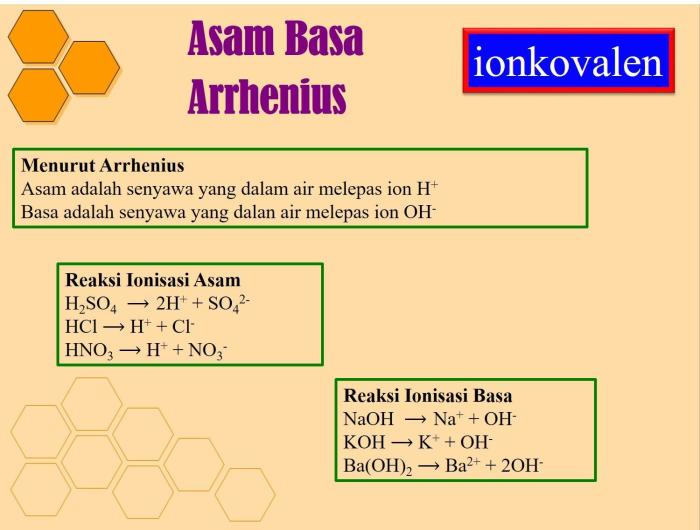
Dalam reaksi ionisasi asam basa, asam adalah zat yang menyumbangkan proton, sedangkan basa adalah zat yang menerima proton. Reaksi ini dapat direpresentasikan secara umum sebagai berikut:
Asam + Basa → Garam + Air
Produk reaksi adalah garam, yang merupakan senyawa ionik yang terbentuk dari ion positif (kation) dan ion negatif (anion). Air adalah pelarut umum untuk reaksi ini.
Contoh Reaksi Ionisasi Asam Basa
Berikut adalah beberapa contoh reaksi ionisasi asam basa:
- Reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH):
- HCl + NaOH → NaCl + H2O
- Reaksi antara asam asetat (CH3COOH) dan amonia (NH3):
- CH3COOH + NH3 → CH3COONH4
- Reaksi antara air (H2O) dan amonia (NH3):
- H2O + NH3 → NH4+ + OH-
Jenis Asam dan Basa
Dalam kimia, asam dan basa merupakan dua konsep penting yang saling terkait. Asam adalah zat yang melepaskan ion hidrogen (H+) ketika dilarutkan dalam air, sedangkan basa adalah zat yang melepaskan ion hidroksida (OH-) ketika dilarutkan dalam air.
Terdapat berbagai jenis asam dan basa, masing-masing dengan sifat dan kegunaan yang unik. Berikut adalah beberapa jenis asam dan basa yang umum:
Asam Kuat
- Asam klorida (HCl)
- Asam sulfat (H2SO4)
- Asam nitrat (HNO3)
Asam Lemah
- Asam asetat (CH3COOH)
- Asam karbonat (H2CO3)
- Asam sitrat (C6H8O7)
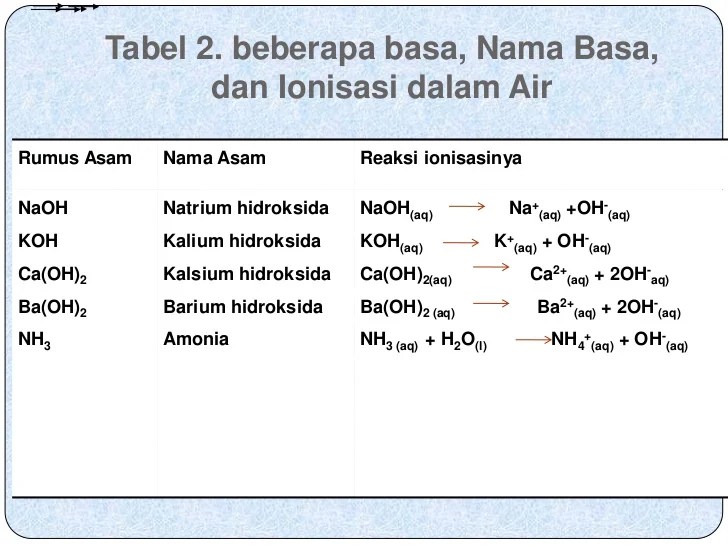
Basa Kuat
- Natrium hidroksida (NaOH)
- Kalium hidroksida (KOH)
- Kalsium hidroksida (Ca(OH)2)
Basa Lemah
- Amonia (NH3)
- Natrium bikarbonat (NaHCO3)
- Magnesium hidroksida (Mg(OH)2)
Kekuatan Asam dan Basa

Kekuatan asam dan basa adalah ukuran seberapa mudah suatu asam atau basa terionisasi dalam larutan. Asam yang kuat terionisasi sepenuhnya dalam larutan, sedangkan basa yang kuat terionisasi sepenuhnya menjadi ion hidroksida (OH – ).
Contoh Asam dan Basa Kuat
- Asam Kuat: HCl, H2SO4, HNO3
- Basa Kuat: NaOH, KOH, Ca(OH)2
Asam dan Basa Lemah
Asam dan basa lemah terionisasi sebagian dalam larutan. Semakin lemah asam atau basa, semakin sedikit ion yang dihasilkannya.
Contoh Asam dan Basa Lemah
- Asam Lemah: CH3COOH (asam asetat), H2CO3 (asam karbonat)
- Basa Lemah: NH3 (amonium hidroksida), NaHCO3 (natrium bikarbonat)
Teori Bronsted-Lowry
Teori Bronsted-Lowry mendefinisikan asam sebagai spesies yang dapat menyumbangkan proton (H+), sedangkan basa adalah spesies yang dapat menerima proton.
Dalam reaksi ionisasi asam basa, asam melepaskan proton yang kemudian diterima oleh basa. Transfer proton ini menghasilkan pasangan asam-basa konjugasi.
Ilustrasi Transfer Proton
Reaksi antara asam klorida (HCl) dan air (H2O) dapat menggambarkan transfer proton:
- HCl bertindak sebagai asam dan melepaskan proton (H+).
- H2O bertindak sebagai basa dan menerima proton, membentuk ion hidronium (H3O+).
- Pasangan asam-basa konjugasi yang dihasilkan adalah HCl (asam) dan Cl- (basa konjugasi).
Aplikasi Reaksi Ionisasi Asam Basa
Reaksi ionisasi asam basa memiliki aplikasi luas dalam kehidupan sehari-hari dan berbagai industri. Reaksi ini berperan penting dalam banyak proses, termasuk:
Kehidupan Sehari-hari
- Pengaturan pH air dan cairan tubuh
- Pencernaan makanan
- Pembersihan dan desinfeksi
- Pembuatan minuman bersoda
Industri
- Produksi bahan kimia, seperti pupuk, plastik, dan deterjen
- Pengolahan air dan limbah
- Industri makanan dan minuman
- Industri farmasi
Dampak Reaksi Ionisasi Asam Basa

Dampak pada Lingkungan
- Pengasaman air: Reaksi ionisasi asam basa dapat menyebabkan pengasaman badan air, seperti danau dan sungai, yang berdampak negatif pada ekosistem akuatik.
- Eutrofikasi: Reaksi ini juga dapat menyebabkan eutrofikasi, di mana badan air menjadi kaya nutrisi, menyebabkan pertumbuhan alga yang berlebihan dan mengurangi kadar oksigen.
Dampak pada Kesehatan Manusia
- Gangguan pencernaan: Reaksi ionisasi asam basa yang tidak seimbang di dalam tubuh dapat menyebabkan gangguan pencernaan, seperti sakit maag dan refluks asam.
- Gangguan pernapasan: Reaksi ini juga dapat memengaruhi sistem pernapasan, menyebabkan iritasi tenggorokan dan paru-paru.
Simpulan Akhir
Reaksi ionisasi asam basa merupakan aspek fundamental kimia yang membentuk dasar banyak fenomena penting. Memahami prinsip-prinsip yang mendasari reaksi ini tidak hanya memperluas pengetahuan kimia, tetapi juga memberikan apresiasi yang lebih dalam tentang dunia di sekitar kita.
Tanya Jawab (Q&A)
Apa perbedaan antara asam kuat dan asam lemah?
Asam kuat berdisosiasi sempurna dalam air, melepaskan semua protonnya, sedangkan asam lemah hanya berdisosiasi sebagian.
Bagaimana teori Bronsted-Lowry mendefinisikan asam dan basa?
Teori Bronsted-Lowry mendefinisikan asam sebagai pemberi proton dan basa sebagai penerima proton.
Apa saja contoh aplikasi reaksi ionisasi asam basa?
Aplikasi meliputi produksi obat-obatan, industri makanan, dan pengendalian pH.