Dalam dunia elektrokimia, reaksi spontan sel volta memainkan peran penting dalam mengonversi energi kimia menjadi energi listrik. Reaksi-reaksi ini merupakan proses spontan yang menghasilkan arus listrik melalui sel elektrokimia, yang terdiri dari dua elektroda yang terendam dalam larutan elektrolit.
Proses ini didorong oleh perbedaan potensial antara dua elektroda, yang ditentukan oleh sifat kimia dari reaktan dan produk yang terlibat dalam reaksi. Faktor-faktor seperti konsentrasi reaktan, temperatur, dan luas permukaan elektroda juga mempengaruhi spontanitas reaksi.
Pengertian Reaksi Spontan Sel Volta
Reaksi spontan sel volta adalah reaksi redoks yang terjadi secara spontan, menghasilkan arus listrik.
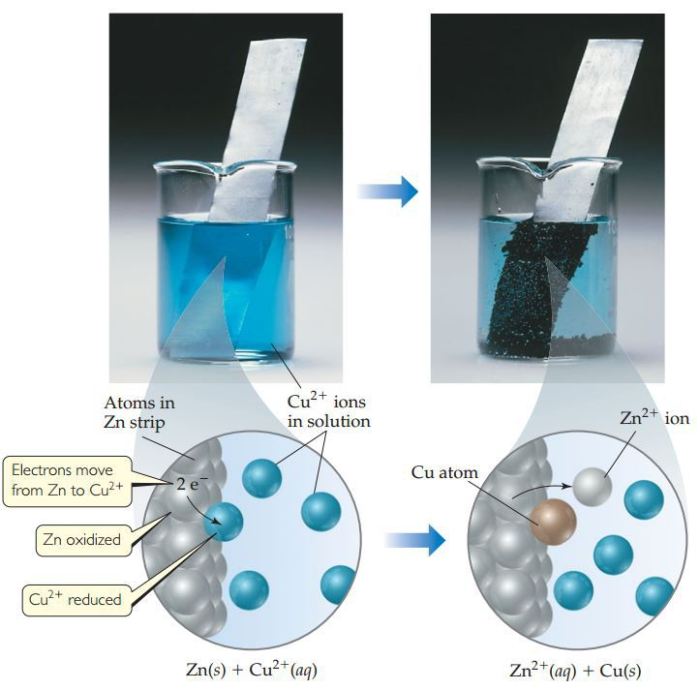
Dalam reaksi ini, spesies yang teroksidasi memiliki potensial reduksi yang lebih tinggi daripada spesies yang tereduksi, sehingga elektron mengalir dari spesies yang teroksidasi ke spesies yang tereduksi.
Contoh Reaksi Spontan Sel Volta
- Reaksi antara seng (Zn) dan tembaga (Cu): Zn + Cu2+ → Zn2+ + Cu
- Reaksi antara besi (Fe) dan perak (Ag): Fe + 2Ag+ → Fe2+ + 2Ag
Faktor-faktor yang Mempengaruhi Reaksi Spontan Sel Volta
Reaksi spontan sel volta dipengaruhi oleh beberapa faktor, antara lain:
Potensial Sel
Potensial sel merupakan perbedaan potensial antara kedua elektroda dalam sel volta. Semakin besar potensial sel, semakin spontan reaksi yang terjadi.
Konsentrasi Reaksi dan Produk
Konsentrasi reaktan dan produk juga mempengaruhi reaksi spontan sel volta. Peningkatan konsentrasi reaktan akan meningkatkan laju reaksi, sedangkan peningkatan konsentrasi produk akan menurunkan laju reaksi.
Temperatur
Temperatur mempengaruhi reaksi spontan sel volta. Peningkatan temperatur umumnya meningkatkan laju reaksi, termasuk reaksi spontan dalam sel volta.
Aplikasi Reaksi Spontan Sel Volta
Reaksi spontan sel volta memiliki banyak aplikasi penting dalam kehidupan sehari-hari, termasuk:
Baterai
- Baterai sel kering digunakan dalam berbagai perangkat elektronik, seperti jam, senter, dan mainan.
- Baterai timbal-asam digunakan dalam kendaraan dan sistem daya cadangan.
- Baterai lithium-ion digunakan dalam laptop, ponsel, dan perangkat elektronik lainnya.
Sel Bahan Bakar
Sel bahan bakar mengubah energi kimia dari bahan bakar (biasanya hidrogen) menjadi energi listrik melalui reaksi spontan sel volta. Mereka digunakan dalam kendaraan listrik dan sistem pembangkit listrik.
Elektroplating
Elektroplating menggunakan reaksi spontan sel volta untuk melapisi logam dengan logam lain. Proses ini digunakan untuk meningkatkan daya tahan, konduktivitas, atau penampilan logam.
Cara Menghitung Reaksi Spontan Sel Volta

Perhitungan reaksi spontan sel volta melibatkan penentuan potensial sel, yang merupakan ukuran kecenderungan reaksi untuk berlangsung. Potensial sel bergantung pada perbedaan potensial elektroda dari setengah sel yang terlibat dalam reaksi.
Langkah-langkah Menghitung Reaksi Spontan Sel Volta
- Tulis persamaan setengah reaksi untuk setiap setengah sel.
- Tentukan potensial standar reduksi untuk setiap setengah reaksi dari tabel data termodinamika.
- Tambahkan potensial standar reduksi untuk kedua setengah reaksi untuk mendapatkan potensial sel standar (Eo).
- Jika reaksi melibatkan larutan non-standar, gunakan persamaan Nernst untuk menghitung potensial sel (E).
Tabel Rumus dan Penjelasan untuk Menghitung Potensial Sel
| Rumus | Penjelasan |
|---|---|
Eo = Eokatoda
|
Potensial sel standar (E o ) dihitung sebagai selisih potensial standar reduksi katoda dan anoda. |
E = E o
|
Persamaan Nernst digunakan untuk menghitung potensial sel (E) dalam larutan non-standar. Q adalah hasil bagi konsentrasi reaktan dan produk. |
Prosedur Praktikum Reaksi Spontan Sel Volta

Praktikum ini bertujuan untuk mendemonstrasikan reaksi spontan pada sel volta dengan menggunakan reaksi redoks antara logam seng dan tembaga.
Daftar Peralatan dan Bahan
- Plat seng
- Plat tembaga
- Larutan CuSO4
- Larutan ZnSO4
- Voltmeter
- Kabel penghubung
Langkah-langkah Praktikum
- Bersihkan permukaan plat seng dan tembaga dengan amplas.
- Masukkan plat seng ke dalam larutan ZnSO4 dan plat tembaga ke dalam larutan CuSO4.
- Hubungkan plat seng dan tembaga menggunakan kabel penghubung.
- Hubungkan voltmeter pada kedua ujung kabel penghubung.
- Amati pembacaan voltmeter.
- Lepaskan kabel penghubung dan ukur tegangan listrik yang dihasilkan.
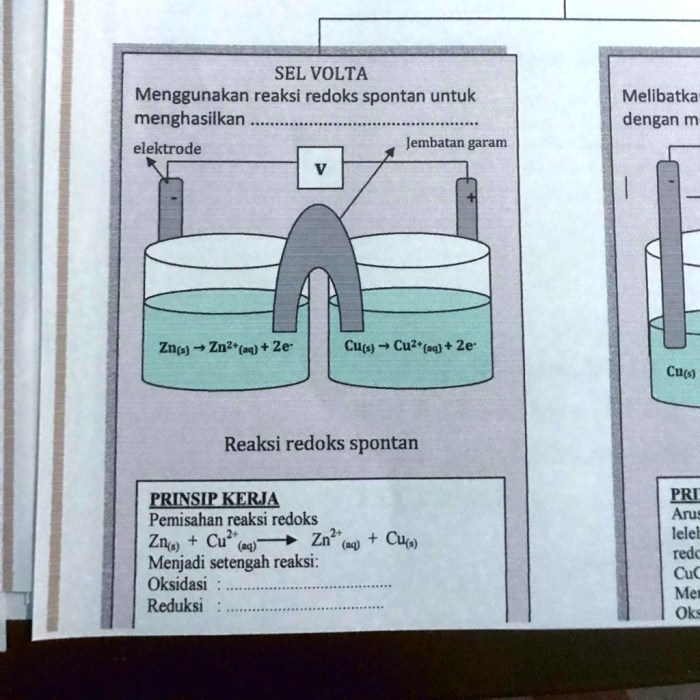
Ilustrasi Reaksi Spontan Sel Volta
Prinsip kerja reaksi spontan sel volta dapat diilustrasikan sebagai berikut:
Skema Sel Volta
Skema sel volta terdiri dari dua elektroda yang terbuat dari logam berbeda yang dicelupkan ke dalam larutan elektrolit.
Elektroda Anoda dan Katoda
Elektroda yang mengalami oksidasi (kehilangan elektron) disebut anoda, sedangkan elektroda yang mengalami reduksi (menerima elektron) disebut katoda.
Reaksi Oksidasi dan Reduksi
Reaksi oksidasi terjadi pada anoda, sedangkan reaksi reduksi terjadi pada katoda.
Aliran Elektron
Elektron mengalir dari anoda ke katoda melalui kawat penghubung eksternal.
Aliran Ion
Untuk menjaga netralitas listrik, ion positif mengalir dari anoda ke katoda melalui larutan elektrolit, sedangkan ion negatif mengalir dari katoda ke anoda.
Reaksi Keseluruhan
Reaksi keseluruhan dalam sel volta adalah reaksi spontan yang menghasilkan energi listrik.
Penutupan
Reaksi spontan sel volta memiliki banyak aplikasi dalam kehidupan sehari-hari, mulai dari baterai yang memberi daya pada perangkat elektronik hingga sel bahan bakar yang menghasilkan listrik dengan efisiensi tinggi. Pemahaman tentang prinsip-prinsip reaksi ini sangat penting untuk kemajuan teknologi elektrokimia dan pemanfaatan energi berkelanjutan.
Pertanyaan Umum (FAQ)
Apa perbedaan antara reaksi spontan dan reaksi tidak spontan?
Reaksi spontan terjadi secara alami dan melepaskan energi, sedangkan reaksi tidak spontan memerlukan input energi untuk terjadi.
Bagaimana cara menentukan apakah reaksi sel volta spontan atau tidak?
Spontanitas reaksi dapat ditentukan dengan menghitung potensial sel. Reaksi spontan memiliki potensial sel positif.
Apa saja faktor yang dapat meningkatkan potensial sel?
Konsentrasi reaktan yang lebih tinggi, temperatur yang lebih tinggi, dan luas permukaan elektroda yang lebih besar dapat meningkatkan potensial sel.