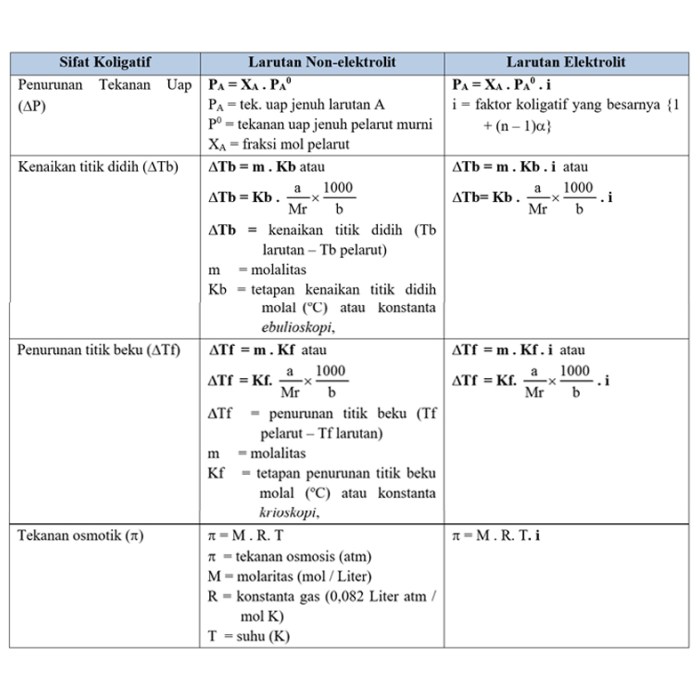
Sifat koligatif larutan, seperti penurunan titik beku dan peningkatan titik didih, sangat dipengaruhi oleh kehadiran elektrolit. Larutan elektrolit, yang mengandung ion, menunjukkan sifat koligatif yang berbeda dibandingkan dengan larutan nonelektrolit karena disosiasi ionnya. Memahami rumus sifat koligatif larutan elektrolit sangat penting dalam berbagai bidang, seperti kimia, biologi, dan teknik.
Perbedaan sifat koligatif antara larutan elektrolit dan nonelektrolit disebabkan oleh kehadiran ion-ion dalam larutan elektrolit. Ion-ion ini memperkuat efek partikel terlarut pada sifat koligatif, sehingga memberikan penyimpangan dari nilai yang diharapkan untuk larutan nonelektrolit.
Definisi Sifat Koligatif Larutan Elektrolit

Sifat koligatif adalah sifat larutan yang bergantung pada jumlah partikel terlarut, bukan pada jenis partikelnya. Elektrolit adalah zat yang ketika dilarutkan dalam pelarut, akan terurai menjadi ion-ion, sehingga meningkatkan jumlah partikel terlarut dalam larutan.
Sifat koligatif larutan elektrolit dipengaruhi oleh jumlah ion yang dihasilkan saat elektrolit terurai. Larutan elektrolit yang kuat, seperti NaCl, terurai sempurna menjadi ion-ionnya, sehingga menghasilkan lebih banyak partikel terlarut dan memiliki efek yang lebih besar pada sifat koligatif dibandingkan dengan larutan elektrolit lemah, seperti asam asetat (CH 3 COOH), yang hanya terurai sebagian menjadi ion-ionnya.
Penurunan Titik Beku
- Titik beku larutan elektrolit lebih rendah daripada titik beku pelarut murni.
- Penurunan titik beku sebanding dengan konsentrasi molal larutan.
- Konstanta penurunan titik beku (Kf) adalah sifat spesifik pelarut.
- Rumus penurunan titik beku: ΔTf = Kf × m
- Dimana ΔTf adalah penurunan titik beku, Kf adalah konstanta penurunan titik beku, dan m adalah konsentrasi molal larutan.
Peningkatan Titik Didih
- Titik didih larutan elektrolit lebih tinggi daripada titik didih pelarut murni.
- Peningkatan titik didih sebanding dengan konsentrasi molal larutan.
- Konstanta peningkatan titik didih (Kb) adalah sifat spesifik pelarut.
- Rumus peningkatan titik didih: ΔTb = Kb × m
- Dimana ΔTb adalah peningkatan titik didih, Kb adalah konstanta peningkatan titik didih, dan m adalah konsentrasi molal larutan.
Tekanan Osmotik
- Tekanan osmotik adalah tekanan yang diperlukan untuk mencegah aliran air dari pelarut murni ke larutan.
- Tekanan osmotik sebanding dengan konsentrasi molal larutan.
- Konstanta tekanan osmotik (π) adalah sifat spesifik pelarut.
- Rumus tekanan osmotik: π = M × R × T
- Dimana π adalah tekanan osmotik, M adalah konsentrasi molal larutan, R adalah konstanta gas (0,0821 L atm / mol K), dan T adalah suhu (K).
Rumus Penurunan Titik Beku
Penurunan titik beku adalah salah satu sifat koligatif larutan, yang menyatakan bahwa titik beku pelarut akan menurun ketika zat terlarut ditambahkan. Penurunan titik beku ini bergantung pada konsentrasi dan sifat zat terlarut.
Rumus Penurunan Titik Beku untuk Larutan Elektrolit
Untuk larutan elektrolit, penurunan titik beku dinyatakan dengan rumus:$$\Delta T_f = K_f \cdot m \cdot i$$di mana:* $\Delta T_f$ adalah penurunan titik beku (dalam derajat Celcius)
- $K_f$ adalah konstanta penurunan titik beku pelarut (dalam derajat Celcius per molalitas)
- $m$ adalah molalitas larutan (dalam mol zat terlarut per kilogram pelarut)
- $i$ adalah faktor van’t Hoff, yang menunjukkan jumlah ion yang dihasilkan oleh satu molekul zat terlarut
Faktor van’t Hoff bergantung pada jenis zat terlarut:* Elektrolit kuat: $i = n$, di mana $n$ adalah jumlah ion yang dihasilkan oleh satu molekul zat terlarut
Elektrolit lemah
$i < n$ - Elektrolit tak elektrolit: $i = 1$
Rumus Peningkatan Titik Didih
Peningkatan titik didih adalah kenaikan titik didih larutan dibandingkan dengan titik didih pelarut murninya. Rumus peningkatan titik didih untuk larutan elektrolit adalah:ΔTb = Kb x m x idi mana:
- ΔTb adalah peningkatan titik didih (dalam derajat Celcius)
- Kb adalah konstanta kenaikan titik didih molal (dalam derajat Celcius per molal)
- m adalah molalitas larutan (dalam mol zat terlarut per kilogram pelarut)
- i adalah faktor van’t Hoff
Faktor van’t Hoff
Faktor van’t Hoff adalah angka yang menunjukkan jumlah ion yang dihasilkan oleh satu molekul zat terlarut saat dilarutkan dalam air. Untuk elektrolit kuat, faktor van’t Hoff sama dengan jumlah ion yang dihasilkan. Misalnya, untuk NaCl, faktor van’t Hoff adalah 2 karena satu molekul NaCl menghasilkan dua ion (Na+ dan Cl-).
Konstanta Kenaikan Titik Didih Molal
Konstanta kenaikan titik didih molal adalah konstanta yang spesifik untuk pelarut tertentu. Nilai Kb untuk air adalah 0,512 derajat Celcius per molal.
Contoh
Misalkan kita memiliki larutan NaCl 0,1 molal. Faktor van’t Hoff untuk NaCl adalah
Menggunakan rumus peningkatan titik didih, kita dapat menghitung peningkatan titik didih larutan sebagai berikut:
ΔTb = Kb x m x iΔTb = 0,512 derajat Celcius per molal x 0,1 molal x 2ΔTb = 0,1024 derajat CelciusJadi, titik didih larutan NaCl 0,1 molal akan meningkat sebesar 0,1024 derajat Celcius dibandingkan dengan titik didih air murni.
Rumus Tekanan Osmotik
Tekanan osmotik adalah tekanan yang diperlukan untuk menghentikan aliran air melalui membran semipermeabel dari larutan dengan konsentrasi lebih rendah ke larutan dengan konsentrasi lebih tinggi. Bagi larutan elektrolit, tekanan osmotiknya dapat dihitung menggunakan rumus:
π = iMRT
di mana:
- π adalah tekanan osmotik (atm)
- i adalah faktor van’t Hoff
- M adalah molalitas larutan (mol/kg pelarut)
- R adalah konstanta gas ideal (0,0821 L atm/mol K)
- T adalah suhu (K)
Faktor van’t Hoff
Faktor van’t Hoff (i) adalah faktor yang memperhitungkan jumlah partikel dalam larutan elektrolit yang dihasilkan oleh disosiasi elektrolit. Faktor ini bergantung pada jenis elektrolit dan konsentrasinya. Untuk elektrolit kuat, faktor van’t Hoff sama dengan jumlah ion yang dihasilkan oleh disosiasi elektrolit.
Misalnya, untuk NaCl, faktor van’t Hoff adalah 2 karena setiap molekul NaCl terdisosiasi menjadi ion Na+ dan Cl-. Untuk elektrolit lemah, faktor van’t Hoff kurang dari jumlah ion yang dihasilkan karena tidak semua molekul elektrolit terdisosiasi.
Faktor van’t Hoff
Faktor van’t Hoff (i) adalah faktor yang digunakan untuk mengoreksi penyimpangan sifat koligatif larutan elektrolit dari perilaku larutan ideal. Faktor ini mewakili jumlah partikel yang dihasilkan oleh satu unit formula elektrolit ketika dilarutkan dalam air.
Nilai faktor van’t Hoff memengaruhi besarnya sifat koligatif larutan elektrolit, seperti penurunan titik beku, kenaikan titik didih, dan tekanan osmotik. Semakin besar nilai i, semakin besar penyimpangan sifat koligatif larutan dari perilaku ideal.
Faktor yang Memengaruhi Nilai Faktor van’t Hoff
- Jenis elektrolit: Elektrolit kuat (seperti NaCl) terdisosiasi sempurna dalam air, menghasilkan nilai i yang besar. Sementara elektrolit lemah (seperti CH3COOH) hanya terdisosiasi sebagian, menghasilkan nilai i yang lebih kecil.
- Konsentrasi larutan: Pada konsentrasi rendah, faktor van’t Hoff mendekati nilai teoritisnya. Namun, pada konsentrasi tinggi, interaksi antar ion dapat menyebabkan penyimpangan dari perilaku ideal, sehingga nilai i berkurang.
- Temperatur: Temperatur memengaruhi tingkat disosiasi elektrolit. Pada suhu yang lebih tinggi, disosiasi elektrolit meningkat, menghasilkan nilai i yang lebih besar.
- Sifat pelarut: Sifat pelarut juga dapat memengaruhi faktor van’t Hoff. Pelarut polar, seperti air, cenderung melarutkan ion secara lebih efektif, menghasilkan nilai i yang lebih besar.
Aplikasi Sifat Koligatif
Sifat koligatif larutan elektrolit memiliki banyak aplikasi penting dalam berbagai bidang.
Kimia
Sifat koligatif digunakan untuk:
- Menentukan massa molar zat terlarut
- Menghitung konsentrasi larutan
- Memprediksi titik beku dan titik didih larutan
Biologi
Sifat koligatif berperan penting dalam:
- Mengatur tekanan osmotik sel
- Mempelajari proses fisiologis, seperti osmosis dan difusi
- Mengembangkan terapi untuk kondisi medis yang melibatkan ketidakseimbangan cairan
Teknik
Sifat koligatif dimanfaatkan dalam:
- Desain sistem pendingin dan pemanas
- Pengembangan bahan baru dengan sifat khusus
- Pemantauan kualitas air dan lingkungan
Contoh Spesifik
Salah satu aplikasi praktis sifat koligatif adalah dalam menentukan konsentrasi larutan gula. Dengan mengukur penurunan titik beku larutan gula, massa molar gula dapat ditentukan, yang kemudian dapat digunakan untuk menghitung konsentrasi larutan.
Penutup
Rumus sifat koligatif larutan elektrolit sangat penting untuk memahami perilaku larutan elektrolit dan memprediksi sifat koligatifnya. Dengan mempertimbangkan faktor van’t Hoff, yang memperhitungkan jumlah ion yang dihasilkan oleh elektrolit, kita dapat secara akurat memprediksi perubahan sifat koligatif larutan elektrolit. Pemahaman yang komprehensif tentang rumus ini memungkinkan kita untuk memanfaatkan sifat koligatif larutan elektrolit dalam berbagai aplikasi praktis, seperti penentuan konsentrasi, pemisahan larutan, dan pengukuran sifat fisik.
Ringkasan FAQ
Apa itu faktor van’t Hoff?
Faktor van’t Hoff adalah bilangan yang menunjukkan jumlah ion yang dihasilkan oleh satu molekul elektrolit ketika dilarutkan. Ini memperhitungkan disosiasi elektrolit dan digunakan untuk menyesuaikan rumus sifat koligatif untuk larutan elektrolit.
Bagaimana faktor van’t Hoff memengaruhi sifat koligatif?
Faktor van’t Hoff meningkatkan nilai sifat koligatif larutan elektrolit dibandingkan dengan larutan nonelektrolit. Semakin besar faktor van’t Hoff, semakin besar efek elektrolit pada sifat koligatif.
Apa saja aplikasi sifat koligatif larutan elektrolit?
Sifat koligatif larutan elektrolit digunakan dalam berbagai aplikasi, seperti penentuan konsentrasi larutan, pemisahan campuran dengan elektroforesis, dan pengukuran berat molekul zat terlarut.
