Rumusan tetapan kesetimbangan untuk reaksi – Rumusan tetapan kesetimbangan, konsep penting dalam kimia, memberikan wawasan tentang perilaku reaksi kimia pada kesetimbangan. Ini adalah konstanta yang menggambarkan hubungan konsentrasi reaktan dan produk pada kesetimbangan, memungkinkan prediksi arah reaksi dan sifat kesetimbangan.
Rumusan tetapan kesetimbangan digunakan secara luas dalam berbagai bidang kimia, termasuk prediksi hasil reaksi, perancangan proses industri, dan pemahaman kesetimbangan biologis. Dengan memahami rumusan ini, kita dapat memperoleh pemahaman yang lebih dalam tentang reaksi kimia dan perilakunya pada kondisi kesetimbangan.
Pengertian Rumusan Tetapan Kesetimbangan
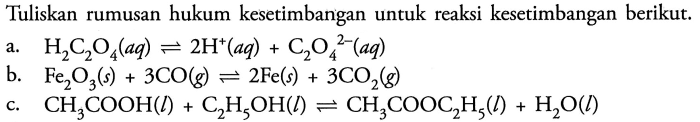
Tetapan kesetimbangan (Kc) adalah nilai konstan yang menggambarkan perbandingan konsentrasi zat-zat reaktan dan produk pada saat kesetimbangan kimia.
Kesetimbangan kimia adalah keadaan ketika laju reaksi maju dan mundur sama, sehingga konsentrasi zat-zat yang terlibat dalam reaksi tidak berubah seiring waktu.
Rumus Tetapan Kesetimbangan
Rumus umum tetapan kesetimbangan untuk reaksi:
aA + bB ⇌ cC + dD
Rumusan tetapan kesetimbangan untuk reaksi menyatakan bahwa nisbah konsentrasi reaktan dan produk pada kesetimbangan adalah konstan. Limbah kotak kemasan dapat kita temui pada berbagai lokasi , termasuk tempat pembuangan akhir dan lingkungan laut. Hal ini menunjukkan pentingnya pemahaman tentang rumusan tetapan kesetimbangan untuk reaksi dalam pengelolaan limbah, karena dapat membantu memprediksi distribusi dan perilaku limbah di lingkungan.
adalah:
Kc = [C]^c[D]^d / [A]^a[B]^b
Rumusan tetapan kesetimbangan untuk reaksi kimia sangat penting dalam memprediksi arah dan hasil suatu reaksi. Dalam materi bahasa Indonesia kelas 6 semester 1 , siswa mempelajari tentang berbagai aspek bahasa, termasuk tata bahasa dan keterampilan menulis. Menariknya, konsep rumusan tetapan kesetimbangan ini dapat diterapkan dalam bahasa Indonesia, di mana keseimbangan antara unsur-unsur bahasa, seperti kata, frasa, dan kalimat, sangat penting untuk menghasilkan teks yang efektif dan komunikatif.
Rumusan tetapan kesetimbangan untuk reaksi memberikan dasar yang kuat untuk memahami dinamika bahasa Indonesia dan bagaimana keseimbangan antarunsurnya memengaruhi pemahaman dan ekspresi.
- Kc adalah tetapan kesetimbangan
- [A], [B], [C], dan [D] adalah konsentrasi molar zat-zat tersebut pada kesetimbangan
- a, b, c, dan d adalah koefisien stoikiometri zat-zat tersebut dalam persamaan reaksi
Contoh
Untuk reaksi:
H2 + I2 ⇌ 2HI
Rumus tetapan kesetimbangannya adalah:
Kc = [HI]^2 / [H2][I2]
Rumusan tetapan kesetimbangan untuk reaksi merupakan persamaan yang menyatakan hubungan antara konsentrasi reaktan dan produk pada kesetimbangan. Persamaan ini penting untuk memprediksi arah dan hasil reaksi kimia. Namun, memahami dan menerapkan rumusan ini dapat menjadi pertanyaan tentang karya ilmiah yang sulit bagi siswa.
Kesulitan ini dapat diatasi dengan memahami konsep dasar kesetimbangan dan dengan berlatih memecahkan masalah terkait rumusan tetapan kesetimbangan.
Jenis-jenis Tetapan Kesetimbangan
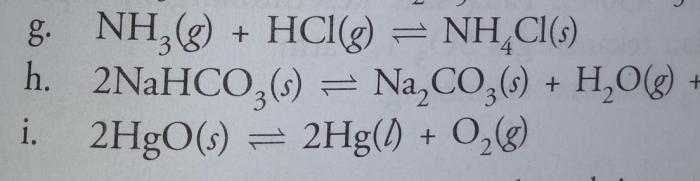
Dalam reaksi kesetimbangan, tetapan kesetimbangan adalah nilai yang menyatakan perbandingan konsentrasi atau tekanan zat-zat yang bereaksi dan hasil reaksi pada saat kesetimbangan tercapai. Terdapat beberapa jenis tetapan kesetimbangan, antara lain:
Tetapan Kesetimbangan Konsentrasi
Tetapan kesetimbangan konsentrasi (Kc) adalah nilai yang menyatakan perbandingan konsentrasi zat-zat yang bereaksi dan hasil reaksi pada saat kesetimbangan tercapai. Kc dinyatakan dalam satuan molaritas (M).
Tetapan Kesetimbangan Tekanan
Tetapan kesetimbangan tekanan (Kp) adalah nilai yang menyatakan perbandingan tekanan parsial zat-zat yang bereaksi dan hasil reaksi pada saat kesetimbangan tercapai. Kp dinyatakan dalam satuan pascal (Pa).
Tetapan Kesetimbangan Parsial
Tetapan kesetimbangan parsial (Ki) adalah nilai yang menyatakan perbandingan tekanan parsial zat-zat yang bereaksi dan hasil reaksi dalam campuran gas pada saat kesetimbangan tercapai. Ki dinyatakan dalam satuan pascal (Pa).
Faktor yang Mempengaruhi Tetapan Kesetimbangan: Rumusan Tetapan Kesetimbangan Untuk Reaksi

Tetapan kesetimbangan adalah konstanta yang menyatakan rasio konsentrasi zat-zat dalam suatu reaksi kimia pada kesetimbangan. Tetapan kesetimbangan dapat dipengaruhi oleh beberapa faktor, antara lain:
Suhu
Peningkatan suhu umumnya menggeser kesetimbangan ke arah reaksi endotermik, yaitu reaksi yang menyerap panas. Sebaliknya, penurunan suhu menggeser kesetimbangan ke arah reaksi eksotermik, yaitu reaksi yang melepaskan panas.
Konsentrasi
Perubahan konsentrasi reaktan atau produk dapat mempengaruhi tetapan kesetimbangan. Peningkatan konsentrasi reaktan menggeser kesetimbangan ke arah produk, sedangkan peningkatan konsentrasi produk menggeser kesetimbangan ke arah reaktan.
Tekanan
Untuk reaksi gas, perubahan tekanan dapat mempengaruhi tetapan kesetimbangan. Peningkatan tekanan menggeser kesetimbangan ke arah sisi reaksi dengan volume gas yang lebih kecil, sedangkan penurunan tekanan menggeser kesetimbangan ke arah sisi reaksi dengan volume gas yang lebih besar.
Volume
Untuk reaksi dalam larutan, perubahan volume tidak mempengaruhi tetapan kesetimbangan karena konsentrasi zat tidak berubah.
Penerapan Rumusan Tetapan Kesetimbangan
Rumusan tetapan kesetimbangan merupakan alat yang ampuh dalam kimia yang digunakan untuk memprediksi dan menghitung berbagai aspek reaksi kesetimbangan. Penerapannya meliputi:
Memprediksi Arah Reaksi
Rumusan tetapan kesetimbangan dapat digunakan untuk memprediksi apakah suatu reaksi akan berlangsung spontan atau tidak pada kondisi tertentu. Jika tetapan kesetimbangan lebih besar dari 1, reaksi akan berlangsung spontan ke arah produk. Jika kurang dari 1, reaksi akan berlangsung spontan ke arah reaktan.
Menghitung Konsentrasi Kesetimbangan
Rumusan tetapan kesequilibrium juga dapat digunakan untuk menghitung konsentrasi zat reaktan dan produk pada keadaan kesetimbangan. Ini sangat berguna untuk merancang dan mengoptimalkan proses industri.
Mendesain Proses Industri
Pemahaman tentang rumusan tetapan kesetimbangan sangat penting dalam mendesain proses industri yang melibatkan reaksi kesetimbangan. Dengan mengontrol kondisi reaksi, seperti suhu, tekanan, dan konsentrasi, proses dapat dioptimalkan untuk memaksimalkan hasil dan meminimalkan biaya.
Cara Menghitung Tetapan Kesetimbangan

Tetapan kesetimbangan adalah nilai konstan yang menyatakan perbandingan konsentrasi reaktan dan produk pada kesetimbangan. Menghitung tetapan kesetimbangan sangat penting untuk memahami dinamika reaksi kimia dan memprediksi arah reaksi.
Menghitung Tetapan Kesetimbangan dari Data Eksperimen, Rumusan tetapan kesetimbangan untuk reaksi
Tetapan kesetimbangan dapat dihitung dari data eksperimen menggunakan rumus berikut:
Keq = [Produk]^a / [Reaktan]^b
Dimana:
- Keq adalah tetapan kesetimbangan
- [Produk] dan [Reaktan] adalah konsentrasi molar produk dan reaktan pada kesetimbangan
- a dan b adalah koefisien stoikiometri produk dan reaktan
Contoh Perhitungan Tetapan Kesetimbangan
Misalkan reaksi berikut:
aA + bB ⇌ cC + dD
Pada kesetimbangan, konsentrasi molar produk dan reaktan adalah sebagai berikut:
- [C] = 0,1 M
- [D] = 0,2 M
- [A] = 0,3 M
- [B] = 0,4 M
Menggunakan rumus tetapan kesetimbangan, kita dapat menghitung Keq sebagai berikut:
Keq = [C]^c[D]^d / [A]^a[B]^b
Keq = (0,1)^c(0,2)^d / (0,3)^a(0,4)^b
Keq = 0,008
Contoh Rumusan Tetapan Kesetimbangan
Rumus tetapan kesetimbangan sangat penting untuk memahami dan memprediksi perilaku reaksi kimia. Berikut adalah beberapa contoh rumusan tetapan kesetimbangan untuk berbagai jenis reaksi:
Reaksi Gas
Untuk reaksi gas, tetapan kesetimbangan dinyatakan dalam satuan tekanan parsial. Rumus umumnya adalah:
Kp= (P AaP Bb…) / (P CcP Dd…)
Dimana K padalah tetapan kesetimbangan tekanan parsial, P adalah tekanan parsial masing-masing gas, dan a, b, c, d adalah koefisien stoikiometri dari reaktan dan produk.
Reaksi Larutan
Untuk reaksi larutan, tetapan kesetimbangan dinyatakan dalam satuan konsentrasi molar. Rumus umumnya adalah:
Kc= [A] a[B] b… / [C] c[D] d…
Dimana K cadalah tetapan kesetimbangan konsentrasi, [ ] adalah konsentrasi molar masing-masing zat terlarut, dan a, b, c, d adalah koefisien stoikiometri dari reaktan dan produk.
Reaksi Heterogen
Untuk reaksi heterogen, tetapan kesequilibrium dapat dinyatakan dalam satuan tekanan parsial dan konsentrasi molar. Rumus umumnya adalah:
Kheterogen= (P AaP Bb…)[C] c[D] d…
Dimana K heterogenadalah tetapan kesetimbangan heterogen, P adalah tekanan parsial gas, [ ] adalah konsentrasi molar zat terlarut, dan a, b, c, d adalah koefisien stoikiometri dari reaktan dan produk.
Ilustrasi Grafik Tetapan Kesetimbangan

Tetapan kesetimbangan dapat digambarkan secara grafis dengan memplot konsentrasi reaktan dan produk pada kesetimbangan terhadap waktu. Grafik ini menunjukkan bagaimana konsentrasi berubah seiring waktu hingga mencapai kesetimbangan.
Hubungan Konsentrasi Reaktan dan Produk
Pada awal reaksi, konsentrasi reaktan tinggi, sedangkan konsentrasi produk rendah. Seiring berjalannya waktu, konsentrasi reaktan menurun dan konsentrasi produk meningkat. Pada kesetimbangan, konsentrasi reaktan dan produk tidak berubah lagi.
Peranan Tetapan Kesetimbangan
Tetapan kesetimbangan tercermin dalam grafik sebagai garis horizontal yang memotong sumbu y pada nilai tetapan kesetimbangan. Garis ini menunjukkan konsentrasi produk pada kesetimbangan untuk konsentrasi reaktan tertentu.
Interpretasi Grafik
Grafik tetapan kesetimbangan dapat digunakan untuk:
- Menentukan apakah reaksi telah mencapai kesetimbangan.
- Memprediksi konsentrasi produk pada kesetimbangan untuk konsentrasi reaktan tertentu.
- Menilai efek perubahan kondisi pada posisi kesetimbangan.
Penutupan

Rumusan tetapan kesetimbangan memainkan peran penting dalam kimia, menyediakan alat yang berharga untuk memahami dan memprediksi perilaku reaksi kimia. Dengan menggunakan konsep ini, para ilmuwan dapat memperoleh wawasan yang lebih dalam tentang sifat kesetimbangan dan memanfaatkannya untuk aplikasi praktis yang tak terhitung jumlahnya.
Area Tanya Jawab
Apa itu rumusan tetapan kesetimbangan?
Rumusan tetapan kesetimbangan adalah konstanta yang menggambarkan hubungan konsentrasi reaktan dan produk pada kesetimbangan.
Apa faktor yang mempengaruhi tetapan kesetimbangan?
Faktor yang mempengaruhi tetapan kesetimbangan meliputi suhu, konsentrasi, tekanan, dan volume.
Bagaimana cara menghitung tetapan kesetimbangan?
Tetapan kesetimbangan dapat dihitung dari data eksperimen menggunakan rumus yang sesuai dengan jenis kesetimbangan.
