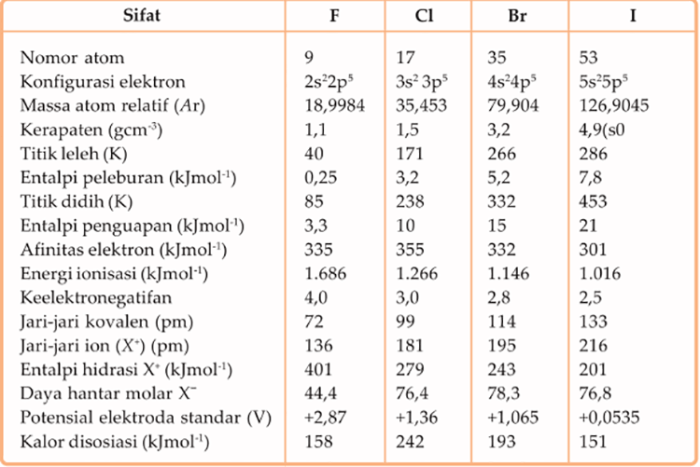
Golongan 3A dalam tabel periodik terdiri dari unsur-unsur boron (B), aluminium (Al), galium (Ga), indium (In), dan talium (Tl). Unsur-unsur ini memiliki sifat fisika yang khas, seperti titik leleh, titik didih, dan kerapatan, yang bervariasi secara sistematis sepanjang golongan.
Pola-pola ini dapat dijelaskan oleh perubahan jumlah elektron valensi dan ukuran atom saat kita bergerak ke bawah golongan. Artikel ini akan mengeksplorasi sifat fisika golongan 3A dan mendiskusikan tren periodik yang diamati.
Sifat Fisika Golongan 3A

Golongan 3A, juga dikenal sebagai golongan boron, terdiri dari unsur boron (B), aluminium (Al), galium (Ga), indium (In), dan talium (Tl). Unsur-unsur ini menunjukkan tren periodik yang jelas dalam sifat fisika mereka.
Titik Leleh dan Titik Didih
- Titik leleh dan titik didih golongan 3A meningkat ke bawah golongan.
- Boron memiliki titik leleh dan titik didih tertinggi, sementara talium memiliki titik leleh dan titik didih terendah.
- Tren ini disebabkan oleh peningkatan ukuran atom dan kekuatan ikatan logam ke bawah golongan.
Kerapatan
- Kerapatan golongan 3A juga meningkat ke bawah golongan.
- Boron memiliki kerapatan terendah, sementara talium memiliki kerapatan tertinggi.
- Peningkatan kerapatan disebabkan oleh peningkatan massa atom dan berkurangnya volume atom ke bawah golongan.
Sifat Reaktivitas Golongan 3A
Golongan 3A dalam tabel periodik, yang terdiri dari boron (B), aluminium (Al), gallium (Ga), indium (In), dan talium (Tl), menunjukkan sifat reaktivitas kimia yang khas.
Pembentukan Ion dan Kecenderungan Oksidasi-Reduksi
Atom golongan 3A memiliki tiga elektron valensi pada orbital ns 2 np 1 . Kehilangan satu elektron menghasilkan ion bermuatan +3, yang sangat stabil karena memiliki konfigurasi gas mulia. Kecenderungan membentuk ion +3 ini menunjukkan bahwa golongan 3A cenderung bertindak sebagai logam.
Dalam reaksi oksidasi-reduksi, golongan 3A biasanya bertindak sebagai agen pereduksi, dengan mudah melepaskan elektron untuk mencapai konfigurasi gas mulia. Kecenderungan ini meningkat dari atas ke bawah golongan, karena jari-jari atom yang lebih besar memfasilitasi pelepasan elektron.
Peran Orbital Valensi dalam Reaktivitas
Orbital valensi np 1 memainkan peran penting dalam menentukan reaktivitas golongan 3A. Orbital ini mudah terhibridisasi dengan orbital ns , menghasilkan hibridisasi sp 2 untuk boron dan sp 3 untuk aluminium dan seterusnya.
Hibridisasi ini memungkinkan golongan 3A membentuk ikatan kovalen yang kuat dengan berbagai unsur, termasuk hidrogen, oksigen, dan halogen. Ikatan kovalen ini berkontribusi pada stabilitas senyawa golongan 3A dan mempengaruhi sifat kimianya secara keseluruhan.
Penggunaan Golongan 3A

Unsur-unsur golongan 3A memiliki sifat unik yang membuat mereka cocok untuk berbagai aplikasi praktis, termasuk dalam baterai, katalis, dan semikonduktor.
Tabel berikut merangkum aplikasi utama unsur-unsur golongan 3A:
| Unsur | Aplikasi |
|---|---|
| Boron | – Serat kaca
|
| Aluminium | – Struktur pesawat dan mobil
|
| Gallium | – Dioda pemancar cahaya (LED)
|
| Indium | – Layar sentuh
|
| Talium | – Detektor radiasi
|
Boron, misalnya, digunakan sebagai bahan penting dalam serat kaca karena sifatnya yang ringan dan kuat. Aluminium digunakan secara luas dalam konstruksi dan pengemasan karena ringan, kuat, dan tahan korosi.
Gallium dan indium digunakan dalam semikonduktor dan perangkat elektronik karena sifat konduktivitas listriknya yang tinggi.
Sifat Khusus Unsur-Unsur Golongan 3A
Unsur-unsur golongan 3A, yang terdiri dari boron (B), aluminium (Al), galium (Ga), indium (In), dan talium (Tl), menunjukkan sifat yang unik dan menarik yang membedakannya dari unsur lain.
Salah satu sifat khusus yang paling menonjol adalah kemampuan boron untuk membentuk ikatan kovalen yang kuat. Ini memberikan boron sifat semikonduktor dan membuatnya berguna dalam aplikasi elektronik. Di sisi lain, aluminium, galium, indium, dan talium adalah logam yang sangat reaktif yang mudah membentuk ion positif.
Sifat Logam dan Nonlogam Boron
Boron adalah satu-satunya unsur dalam golongan 3A yang menunjukkan sifat logam dan nonlogam. Dalam bentuk murni, boron adalah padatan amorf berwarna hitam yang rapuh. Ini memiliki konduktivitas listrik yang rendah dan titik leleh yang tinggi. Namun, ketika dipadukan dengan unsur lain, boron dapat membentuk senyawa dengan sifat yang sangat berbeda.
- Sebagai nonlogam, boron dapat membentuk ikatan kovalen dengan unsur lain, seperti karbon, nitrogen, dan oksigen. Senyawa ini seringkali memiliki sifat keramik, seperti kekerasan dan ketahanan panas yang tinggi.
- Sebagai logam, boron dapat membentuk paduan dengan logam lain, seperti aluminium dan besi. Paduan ini memiliki kekuatan dan ketahanan korosi yang tinggi.
Contoh Reaksi Golongan 3A
Unsur-unsur golongan 3A, yang terdiri dari boron (B), aluminium (Al), gallium (Ga), indium (In), dan thallium (Tl), menunjukkan sifat kimia yang khas dalam berbagai reaksi. Berikut adalah beberapa contoh reaksi umum yang melibatkan unsur-unsur golongan 3A:
Reaksi dengan Halogen
- Unsur-unsur golongan 3A bereaksi dengan halogen (X2) untuk membentuk halida logam trihalida (MX3).
- Reaksi ini bersifat eksotermik dan melepaskan panas.
- Reaksi berlangsung melalui mekanisme substitusi nukleofilik, di mana halogen menggantikan gugus hidrida pada unsur golongan 3A.
Reaksi dengan Oksigen
- Unsur-unsur golongan 3A bereaksi dengan oksigen (O2) untuk membentuk oksida logam (M2O3).
- Reaksi ini juga bersifat eksotermik dan melepaskan panas.
- Reaksi berlangsung melalui mekanisme oksidasi-reduksi, di mana unsur golongan 3A dioksidasi menjadi keadaan oksidasi +3, dan oksigen direduksi menjadi keadaan oksidasi
-2.
Reaksi dengan Air
- Unsur-unsur golongan 3A bereaksi dengan air (H2O) untuk membentuk hidroksida logam (M(OH)3).
- Reaksi ini bersifat eksotermik dan melepaskan panas.
- Reaksi berlangsung melalui mekanisme substitusi nukleofilik, di mana gugus hidroksida menggantikan gugus hidrida pada unsur golongan 3A.
Perbandingan dengan Golongan Lain
Golongan 3A menunjukkan sifat fisika dan kimia yang unik dibandingkan dengan golongan lain dalam tabel periodik. Perbandingan ini memberikan wawasan tentang tren periodik dan hubungan antar unsur.
Tabel berikut menyoroti persamaan dan perbedaan utama antara golongan 3A dan golongan lain:
| Sifat | Golongan 3A | Golongan Lain |
|---|---|---|
| Keadaan Fisik | Padat (kecuali galium) | Beragam (padat, cair, gas) |
| Warna | Putih keperakan | Beragam |
| Kilap | Mengkilap | Beragam |
| Titik Lebur | Relatif rendah (kecuali boron) | Beragam |
| Titik Didih | Relatif tinggi (kecuali boron) | Beragam |
| Konduktivitas Listrik | Baik (kecuali boron) | Beragam |
| Konduktivitas Termal | Baik (kecuali boron) | Beragam |
| Reaktivitas | Reaktif | Beragam |
Persamaan yang diamati antara golongan 3A dan golongan lain meliputi keadaan fisik padat (kecuali galium) dan sifat logam yang baik (kecuali boron). Perbedaan yang mencolok meliputi titik lebur dan titik didih yang relatif rendah (kecuali boron), yang dapat dikaitkan dengan ukuran atom yang kecil dan ikatan logam yang lemah pada golongan 3A.
Selain itu, golongan 3A umumnya lebih reaktif daripada golongan lain karena konfigurasi elektron valensinya yang hanya memiliki tiga elektron. Reaktivitas ini berkontribusi pada pembentukan senyawa yang stabil dan beragam dengan unsur lain.
Kesimpulan Akhir
Sifat fisika golongan 3A menunjukkan tren periodik yang jelas, yang dipengaruhi oleh perubahan jumlah elektron valensi dan ukuran atom. Pemahaman tentang sifat-sifat ini sangat penting untuk memprediksi perilaku dan aplikasi unsur-unsur ini dalam berbagai bidang, seperti elektronik, katalisis, dan bahan semikonduktor.
Ringkasan FAQ
Mengapa unsur-unsur golongan 3A memiliki titik leleh yang rendah?
Titik leleh yang rendah dari unsur-unsur golongan 3A disebabkan oleh ikatan kovalen yang lemah yang terbentuk di antara atom-atomnya. Ikatan ini mudah putus, sehingga membutuhkan energi yang lebih sedikit untuk mengubah padatan menjadi cairan.
Mengapa titik didih unsur-unsur golongan 3A meningkat seiring bertambahnya nomor atom?
Titik didih yang meningkat seiring bertambahnya nomor atom menunjukkan penguatan gaya antarmolekul. Saat ukuran atom bertambah, jumlah elektron valensi juga bertambah, yang mengarah pada peningkatan polarisasi molekul dan kekuatan gaya Van der Waals.
Mengapa kerapatan unsur-unsur golongan 3A meningkat seiring bertambahnya nomor atom?
Peningkatan kerapatan seiring bertambahnya nomor atom disebabkan oleh peningkatan massa atom dan penurunan volume atom. Semakin besar atom, semakin banyak elektron dan proton yang dikandungnya, yang meningkatkan massa. Pada saat yang sama, ukuran atom berkurang karena peningkatan jumlah elektron inti, yang mengarah pada volume yang lebih kecil.