Dalam dunia kimia analitik, titrasi argentometri metode Volhard menonjol sebagai teknik yang sangat dihormati untuk penentuan kuantitatif ion halida. Prinsipnya yang cerdik menggabungkan reaksi pengendapan dan titrasi balik untuk memberikan hasil yang akurat dan andal.
Metode ini dinamai sesuai penemunya, Jacob Volhard, yang mengembangkannya pada akhir abad ke-19. Sejak itu, metode ini telah menjadi alat yang tak ternilai dalam berbagai bidang, termasuk analisis makanan, farmasi, dan lingkungan.
Pengertian Titrasi Argentometri Metode Volhard
Prinsip Titrasi Argentometri Metode Volhard
Titrasi argentometri metode Volhard didasarkan pada prinsip pengendapan ion perak (Ag + ) dengan ion tiosianat (SCN – ) untuk membentuk endapan perak tiosianat (AgSCN) yang berwarna putih dan sukar larut.
Reaksi Kimia dalam Metode Volhard
- Reaksi pengendapan: Ag+ + SCN– → AgSCN (endapan)
- Reaksi pembentukan kompleks: AgSCN + SCN– → [Ag(SCN)2]– (kompleks)
Bahan dan Alat yang Digunakan
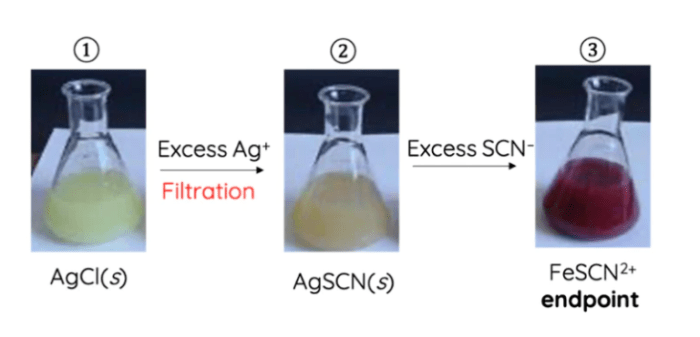
Dalam titrasi argentometri metode Volhard, beberapa bahan kimia dan peralatan diperlukan untuk melakukan analisis secara akurat.
Bahan kimia yang digunakan dalam titrasi ini antara lain:
- Larutan sampel yang mengandung ion klorida (Cl–)
- Larutan perak nitrat (AgNO3) sebagai titran
- Larutan kalium tiosianat (KSCN) sebagai indikator
- Larutan besi(III) amonium sulfat [FeNH4(SO4)2·12H2O] sebagai katalisator
Peralatan yang digunakan dalam titrasi ini meliputi:
- Buret untuk menambahkan larutan perak nitrat
- Pipet untuk mengambil larutan sampel dan indikator
- Erlenmeyer sebagai wadah reaksi
- Pengaduk magnetik untuk mencampur larutan
Prosedur Titrasi
Titrasi argentometri metode Volhard melibatkan penentuan kadar ion halida dalam suatu sampel melalui titrasi dengan larutan perak nitrat standar.
Berikut adalah langkah-langkah umum dalam prosedur titrasi:
Penyiapan Larutan
- Siapkan larutan perak nitrat standar dengan melarutkan sejumlah tertimbang perak nitrat dalam air suling.
- Siapkan larutan sampel yang mengandung ion halida yang akan ditentukan kadarnya.
- Siapkan larutan indikator feroin.
Titrasi
- Pipet volume tertentu larutan sampel ke dalam labu Erlenmeyer.
- Tambahkan larutan asam nitrat pekat untuk membuat lingkungan asam.
- Tambahkan larutan indikator feroin.
- Titrasi dengan larutan perak nitrat standar dari buret hingga titik akhir tercapai.
- Titik akhir ditandai dengan perubahan warna larutan dari merah muda menjadi tidak berwarna.
Perhitungan
Kadar ion halida dalam sampel dapat dihitung menggunakan rumus berikut:
Kadar Halida (M) = (Volume AgNO 3 x Molaritas AgNO 3 ) / Volume Sampel
di mana:
- Volume AgNO3 adalah volume larutan perak nitrat standar yang digunakan dalam titrasi
- Molaritas AgNO3 adalah molaritas larutan perak nitrat standar
- Volume Sampel adalah volume larutan sampel yang diambil
Perhitungan Hasil Titrasi

Perhitungan hasil titrasi argentometri metode Volhard melibatkan penggunaan rumus kimia untuk menentukan konsentrasi analit dalam sampel.
Berikut langkah-langkah perhitungan hasil titrasi:
Penentuan Konsentrasi Analit
- Tentukan mol ion perak (Ag+) yang bereaksi dengan ion tiosianat (SCN-) dalam larutan titran.
- Gunakan persamaan reaksi untuk menghitung mol ion halida (X-) yang bereaksi dengan ion perak.
- Bagikan mol ion halida dengan volume sampel yang diambil untuk mendapatkan konsentrasi analit.
Contoh Perhitungan
Misalkan kita melakukan titrasi 25,00 mL sampel yang mengandung ion halida (X-) dengan larutan standar perak nitrat (AgNO3) 0,100 M. Titrasi mencapai titik akhir pada volume 18,75 mL.
Mol ion perak yang bereaksi: 18,75 mL x 0,100 mol/L = 1,875 x 10^-3 mol
Menurut persamaan reaksi:
Ag+ + SCN- → AgSCN
1 mol Ag+ bereaksi dengan 1 mol SCN-
Mol ion halida yang bereaksi: 1,875 x 10^-3 mol
Konsentrasi analit:
Konsentrasi = Mol ion halida / Volume sampel
Konsentrasi = 1,875 x 10^-3 mol / 25,00 mL
Konsentrasi = 0,0750 M
Sumber Kesalahan dan Cara Mengatasinya
Titrasi argentometri metode Volhard rentan terhadap beberapa sumber kesalahan yang dapat memengaruhi akurasi hasil. Kesalahan-kesalahan ini harus diidentifikasi dan diatasi untuk memastikan hasil yang andal.
Kesalahan Umum dan Cara Mengatasinya
- Kesalahan indikator: Indikator yang digunakan dalam titrasi harus berubah warna secara tajam pada titik ekivalen. Jika perubahan warna tidak jelas, hal ini dapat menyebabkan kesalahan dalam penentuan titik akhir.
- Kesalahan konsentrasi larutan titran: Konsentrasi larutan titran harus diketahui secara akurat. Kesalahan dalam penentuan konsentrasi dapat menyebabkan kesalahan dalam perhitungan konsentrasi analit.
- Kesalahan pengenceran: Pengenceran sampel dan larutan titran harus dilakukan secara akurat. Kesalahan dalam pengenceran dapat menyebabkan kesalahan dalam perhitungan konsentrasi analit.
- Kesalahan titik akhir: Titik akhir titrasi harus ditentukan secara akurat. Kesalahan dalam penentuan titik akhir dapat menyebabkan kesalahan dalam perhitungan konsentrasi analit.
- Kesalahan pengotor: Kehadiran pengotor dalam sampel atau larutan titran dapat memengaruhi hasil titrasi. Pengotor harus dihilangkan atau diperhitungkan untuk memastikan akurasi hasil.
Aplikasi Titrasi Argentometri Metode Volhard
Titrasi argentometri metode Volhard banyak digunakan dalam berbagai bidang karena akurasi dan kesederhanaannya. Berikut adalah beberapa contoh aplikasinya:
Bidang Kimia
- Penentuan kadar ion halida (klorida, bromida, iodida) dalam larutan
- Analisis air minum dan air limbah untuk mendeteksi kadar halida
- Pengujian kemurnian garam halida
Bidang Farmasi
- Analisis kadar ion perak dalam obat-obatan
- Penentuan kadar halida dalam produk farmasi, seperti larutan injeksi dan salep
Bidang Industri
- Kontrol kualitas dalam produksi bahan kimia, seperti natrium klorida dan kalium bromida
- Analisis kadar halida dalam makanan dan minuman
- Pemeriksaan kadar perak dalam perhiasan dan peralatan elektronik
Kelebihan Metode Volhard
- Akurasi tinggi
- Mudah dilakukan dan tidak memerlukan peralatan khusus
- Dapat digunakan untuk menentukan kadar ion halida dalam berbagai konsentrasi
Keterbatasan Metode Volhard
- Tidak dapat digunakan untuk menentukan kadar ion halida dalam larutan yang mengandung ion perak atau ion yang mengendap dengan perak nitrat
- Membutuhkan indikator yang tepat untuk mendapatkan titik akhir yang jelas
- Dapat terpengaruh oleh faktor-faktor seperti suhu dan cahaya
Ringkasan Terakhir

Kesimpulannya, titrasi argentometri metode Volhard menawarkan pendekatan yang kuat dan fleksibel untuk penentuan halida. Dengan ketepatan dan aplikasinya yang luas, metode ini tetap menjadi pilar dalam bidang kimia analitik, memberikan wawasan penting ke dalam konsentrasi halida dalam berbagai sampel.
Tanya Jawab (Q&A)
Apa kelebihan utama titrasi argentometri metode Volhard?
Kelebihannya meliputi akurasi tinggi, selektivitas yang baik terhadap halida, dan kemudahan pelaksanaannya.
Apa saja batasan dari titrasi argentometri metode Volhard?
Metode ini tidak cocok untuk sampel yang mengandung ion lain yang dapat bereaksi dengan perak nitrat, dan dapat dipengaruhi oleh pH larutan.
Bagaimana cara mengatasi kesalahan yang disebabkan oleh ion lain yang bereaksi dengan perak nitrat?
Penggunaan larutan penyangga atau penambahan pengikat spesifik ion dapat meminimalkan interferensi dari ion lain.
