Termokimia merupakan cabang ilmu kimia yang mempelajari hubungan antara perubahan energi dan reaksi kimia. Memahami konsep-konsep termokimia sangat penting untuk berbagai bidang, termasuk kimia, fisika, biologi, dan teknik.
Teks ini akan menyajikan panduan komprehensif tentang termokimia, meliputi konsep dasar, entalpi, entropi, energi bebas Gibbs, persamaan termokimia, kalorimetri, dan aplikasi praktisnya. Setiap topik akan dilengkapi dengan contoh dan soal latihan untuk memperkuat pemahaman Anda.
Konsep Dasar Termokimia
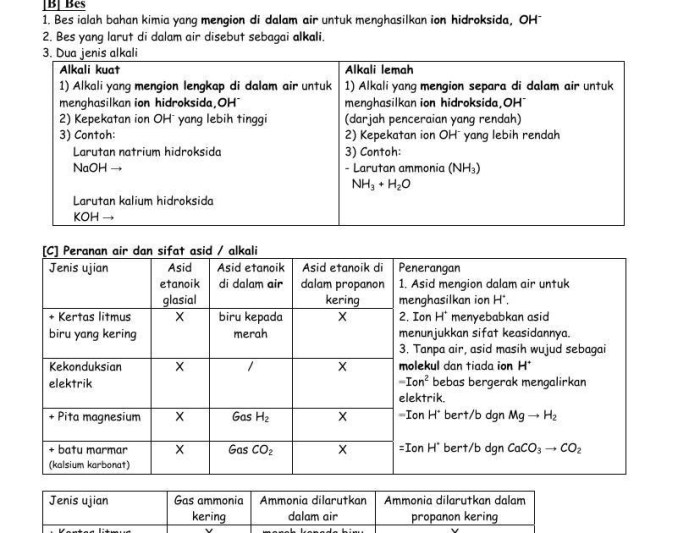
Termokimia adalah cabang kimia yang mempelajari perubahan energi yang menyertai reaksi kimia. Reaksi kimia melibatkan perubahan susunan atom dan molekul, yang biasanya disertai dengan perubahan energi.
Reaksi Eksotermik dan Endotermik
Reaksi kimia dapat diklasifikasikan menjadi dua jenis utama berdasarkan perubahan energinya:
- Reaksi Eksotermik: Reaksi yang melepaskan energi ke lingkungan. Perubahan entalpi reaksi negatif (ΔH < 0).
- Reaksi Endotermik: Reaksi yang menyerap energi dari lingkungan. Perubahan entalpi reaksi positif (ΔH > 0).
Dalam reaksi eksotermik, energi dilepaskan dalam bentuk panas, cahaya, atau suara. Sebaliknya, dalam reaksi endotermik, energi diserap dari lingkungan dalam bentuk panas atau cahaya.
Entalpi dan Entropi
Entalpi dan entropi merupakan dua besaran termodinamika yang sangat penting untuk memahami perubahan energi dan spontanitas reaksi kimia. Entalpi mengukur perubahan panas yang menyertai reaksi kimia, sedangkan entropi mengukur tingkat ketidakteraturan atau acak suatu sistem.
Hubungan antara Entalpi dan Entropi
Entalpi dan entropi saling terkait dalam reaksi kimia. Secara umum, reaksi eksotermik (melepaskan panas) cenderung memiliki entalpi negatif, sedangkan reaksi endotermik (menyerap panas) cenderung memiliki entalpi positif. Sebaliknya, reaksi yang menghasilkan peningkatan ketidakteraturan atau acak cenderung memiliki entropi positif, sedangkan reaksi yang menyebabkan penurunan ketidakteraturan cenderung memiliki entropi negatif.
Contoh Reaksi Eksotermik dan Endotermik
- Eksotermik: Pembakaran metana (CH4) menghasilkan karbon dioksida (CO2) dan air (H2O), melepaskan sejumlah besar panas.
- Endotermik: Dekomposisi air (H2O) menjadi hidrogen (H2) dan oksigen (O2) memerlukan sejumlah besar energi untuk memecah ikatan antara atom-atom hidrogen dan oksigen.
Energi Bebas Gibbs
Energi bebas Gibbs (G) adalah potensial termodinamika yang mengukur kecenderungan suatu sistem untuk melakukan kerja yang berguna. Ini adalah fungsi keadaan, yang berarti nilainya hanya bergantung pada keadaan akhir sistem, bukan pada jalur yang diambil untuk mencapai keadaan tersebut.Energi bebas Gibbs didefinisikan sebagai:G = H
TS
di mana:* G adalah energi bebas Gibbs
- H adalah entalpi
- T adalah suhu
- S adalah entropi
Hubungan antara Energi Bebas Gibbs, Entalpi, dan Entropi
Energi bebas Gibbs, entalpi, dan entropi terkait satu sama lain melalui persamaan:| Parameter | Hubungan ||—|—|| Energi bebas Gibbs (G) | G = H
TS |
| Entalpi (H) | H = G + TS || Entropi (S) | S = (H
G) / T |
Reaksi Spontan dan Tidak Spontan
Reaksi spontan adalah reaksi yang terjadi tanpa masukan energi dari luar. Dalam hal energi bebas Gibbs, reaksi spontan terjadi ketika perubahan energi bebas Gibbs negatif (ΔG < 0). Ini menunjukkan bahwa sistem memiliki kecenderungan alami untuk berubah ke keadaan yang lebih stabil. Sebaliknya,
reaksi tidak spontan adalah reaksi yang memerlukan masukan energi dari luar agar dapat terjadi. Dalam hal energi bebas Gibbs, reaksi tidak spontan terjadi ketika perubahan energi bebas Gibbs positif (ΔG > 0). Ini menunjukkan bahwa sistem tidak memiliki kecenderungan alami untuk berubah ke keadaan yang lebih stabil.
Contoh Reaksi
*
-*Reaksi spontan
Pembakaran metana (ΔG =
- 890 kJ/mol)
-*Reaksi tidak spontan
Elektrolisis air (ΔG = 474 kJ/mol)
Persamaan Termokimia

Persamaan termokimia merupakan representasi reaksi kimia yang mencakup informasi perubahan energi yang menyertai reaksi tersebut. Perubahan energi ini dinyatakan dalam bentuk panas (entalpi) dan dituliskan sebagai persamaan matematika.
Persamaan termokimia memiliki beberapa komponen utama, yaitu:
- Rumus kimia reaktan dan produk
- Tanda panah yang menunjukkan arah reaksi
- Nilai perubahan entalpi (ΔH), yang dapat berupa positif (reaksi endotermik) atau negatif (reaksi eksotermik)
Contoh Persamaan Termokimia
Berikut adalah contoh persamaan termokimia:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O(g) + 890 kJ
Persamaan ini menunjukkan bahwa reaksi pembakaran metana (CH 4 ) melepaskan panas sebesar 890 kJ.
Penggunaan Persamaan Termokimia
Persamaan termokimia dapat digunakan untuk menghitung perubahan entalpi reaksi. Perubahan entalpi merupakan ukuran perubahan energi yang menyertai reaksi kimia dan dapat digunakan untuk memprediksi kelayakan termodinamika suatu reaksi.
Untuk menghitung perubahan entalpi, persamaan termokimia harus seimbang dan nilai perubahan entalpi harus dikalikan dengan koefisien reaktan dan produk yang sesuai.
Kalorimetri
Kalorimetri adalah studi tentang panas dan pengukurannya. Prinsip dasar kalorimetri adalah bahwa panas adalah bentuk energi yang dapat ditransfer antara sistem dan lingkungannya.
Kalorimetri digunakan untuk menentukan perubahan entalpi reaksi, kapasitas kalor spesifik suatu zat, dan panas peleburan atau penguapan.
Jenis-jenis Kalorimeter
Terdapat berbagai jenis kalorimeter, masing-masing dirancang untuk tujuan tertentu. Beberapa jenis kalorimeter yang umum digunakan meliputi:
- Kalorimeter bom: Digunakan untuk mengukur panas pembakaran bahan bakar.
- Kalorimeter kopi: Digunakan untuk mengukur panas spesifik zat padat dan cair.
- Kalorimeter diferensial: Digunakan untuk mengukur perbedaan suhu antara dua sampel.
- Kalorimeter isoperibol: Digunakan untuk mengukur panas reaksi yang berlangsung pada suhu konstan.
Percobaan Kalorimetri untuk Menentukan Perubahan Entalpi Reaksi
Percobaan kalorimetri dapat dirancang untuk menentukan perubahan entalpi reaksi. Perubahan entalpi adalah jumlah panas yang diserap atau dilepaskan oleh suatu sistem selama reaksi pada tekanan konstan.
Berikut adalah langkah-langkah untuk merancang percobaan kalorimetri untuk menentukan perubahan entalpi reaksi:
- Pilih kalorimeter yang sesuai untuk reaksi yang akan dipelajari.
- Tentukan massa reaktan dan produk.
- Ukur suhu awal dan akhir reaksi.
- Hitung perubahan suhu (ΔT).
- Hitung kapasitas kalor kalorimeter dan isinya.
- Hitung perubahan entalpi reaksi menggunakan persamaan berikut:
- C adalah kapasitas kalor kalorimeter dan isinya (J/°C)
- ΔT adalah perubahan suhu (°C)
“`ΔH =
CΔT
“`di mana:* ΔH adalah perubahan entalpi reaksi (J)
Aplikasi Termokimia
Termokimia, studi tentang hubungan antara energi panas dan reaksi kimia, memiliki banyak aplikasi dalam kehidupan sehari-hari, teknik, dan industri.
Contoh Aplikasi Termokimia dalam Kehidupan Sehari-hari
- Pembakaran bahan bakar dalam kendaraan menghasilkan energi panas yang menggerakkan mesin.
- Reaksi kimia dalam baterai menyediakan listrik untuk perangkat elektronik.
- Pemanasan makanan melalui proses memasak mengubah energi kimia menjadi panas.
Pentingnya Termokimia dalam Teknik dan Industri
Termokimia memainkan peran penting dalam teknik dan industri dengan memberikan pemahaman tentang:
- Proses pembakaran yang efisien dalam mesin dan pembangkit listrik.
- Rancangan bahan bakar baru yang lebih efisien dan ramah lingkungan.
- Pengembangan teknologi penyimpanan energi yang efektif, seperti baterai dan sel bahan bakar.
Kutipan Penting
“Termokimia adalah dasar bagi kemajuan teknologi di bidang energi, transportasi, dan produksi industri, memungkinkan kita memanfaatkan energi panas secara efektif dan efisien.”
Ringkasan Penutup

Termokimia memberikan pemahaman yang mendalam tentang sifat energi dan perannya dalam reaksi kimia. Dengan memahami prinsip-prinsip termokimia, kita dapat memprediksi dan mengontrol perubahan energi yang menyertai reaksi kimia, sehingga memungkinkan kita untuk mengembangkan teknologi baru dan memajukan kemajuan ilmiah.
Sudut Pertanyaan Umum (FAQ)
Apa itu reaksi eksotermik dan endotermik?
Reaksi eksotermik melepaskan energi ke lingkungan, sedangkan reaksi endotermik menyerap energi dari lingkungan.
Bagaimana cara menentukan spontanitas reaksi berdasarkan energi bebas Gibbs?
Reaksi spontan memiliki nilai energi bebas Gibbs negatif (ΔG < 0), sedangkan reaksi tidak spontan memiliki nilai energi bebas Gibbs positif (ΔG > 0).
Apa itu kalorimeter dan bagaimana cara kerjanya?
Kalorimeter adalah alat yang digunakan untuk mengukur perubahan panas yang menyertai reaksi kimia. Ini bekerja dengan mengisolasi reaksi dan mengukur perubahan suhu yang dihasilkan.
Apa saja aplikasi praktis termokimia?
Termokimia digunakan dalam berbagai bidang, seperti desain bahan bakar, pengembangan obat-obatan, dan optimalisasi proses industri.
